Le
dioxyde de carbone aux services de l'homme. Bac Sti2d Polynésie
2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Le
laser à dioxyde de carbone CO2.
La chirurgie au laser est largement utilisée dans de nombreuses
spécialités chirurgicales
humaines telles que : oto-rhino-laryngologie, gynécologie,
neurochirurgie, chirurgie plastique,
dermatologie, chirurgie orale et maxillo-faciale. Parmi les différents
types de laser disponibles, le
laser au CO2 est l'instrument de prédilection de
la chirurgie au laser en raison de ses propriétés
exceptionnelles tant en matière de réalisation d'incisions, d'excisions
que d'ablations de tissus à la
fois précises et hémostatiques.
La longueur d’onde du LASER à CO2 utilisé vaut :
l1
= 10,0 μm.
En déduire à quel domaine des ondes électromagnétiques appartiennent
les ondes émises par le LASER à CO2.

L’énergie transportée par un photon vaut : E =h c / l
où h et c sont des constantes et l la longueur d’onde associée aux photons.
Sans calcul, mais en justifiant la réponse, indiquer si les photons du laser CO2 sont plus
énergétiques ou moins énergétiques que ceux du laser « Nd : YAG » Donnée : longueur d’onde du laser « Nd : YAG » : l2 = 1064 nm.
l2 = 1064 10-9 m = 1,064 10-6 m = 1,064 µm.
Plus la longueur d'onde est faible, plus l'énergie des photons est grande. Le laser « Nd : YAG » est plus énergétique que le laser CO2.Pour
soigner les cicatrices d’acné, un traitement au laser consiste à faire
pénétrer un faisceau sur quelques dizaines de micromètres de la peau
(l’épiderme et le derme superficiel). Les photons doivent interagir
avec l’eau contenue dans cet épiderme en la vaporisant.
Justifier que le laser à CO2 est bien adapté au traitement des cicatrices de l’acné.
L'eau présente un maximum d'absorption pour les photons de longueurs d'onde voisines de 10 µm. Le laser à CO2 ne pénètre la peau que sur 0,02 mm. Il est donc bien adapté.
La datation au carbone 14 en médecine légale.
Dans
la haute atmosphère, des réactions nucléaires initiées par le
rayonnement cosmique produisent un flux de neutrons libres. Après avoir
été ralentis par collision avec les molécules de l'air, les neutrons
réagissent avec les noyaux des atomes d'azote pour former des noyaux
d’atome de carbone 14, selon l'équation bilan :
10n +147N ---> 146C +11H.
Après avoir défini l’isotopie, indiquer si les noyaux des atomes d’azote 147N et de carbone 146C sont des isotopes.
Des isotopes ne diffèrent que par leur nombre de neutrons.Ils ont le même numéro atomique. 147N et 146C ne sont pas des isotopes. L'atome de carbone 14, ainsi produit, réagit rapidement avec le dioxygène O2 de l’atmosphère pour former du dioxyde de carbone CO2 qui est assimilé par les plantes lors de la photosynthèse et donc indirectement par les hommes.
Pour
dater un corps carboné, on compare l’activité A (c'est-à-dire le nombre
de noyaux d’atomes de carbone 14 qui se désintègrent par unité de
temps) à l’instant t de l’analyse, avec l'activité A0 d’un même échantillon de carbone 14 récemment « mort ».
L’équation de désintégration du "carbone 14" en "azote 14" s’écrit :
146C --> 147N +0-1e.
Quelle particule est représentée par le symbole 0-1e ? De quel type de radioactivité s’agit-il ?
Un électron est libéré : radioactivité de type béta moins.
Evaluer le temps de demi-vie t ½ du carbone 14. Au bout de combien de temps l’activité ne vaudrait-elle plus que le quart de l’activité initiale A0.
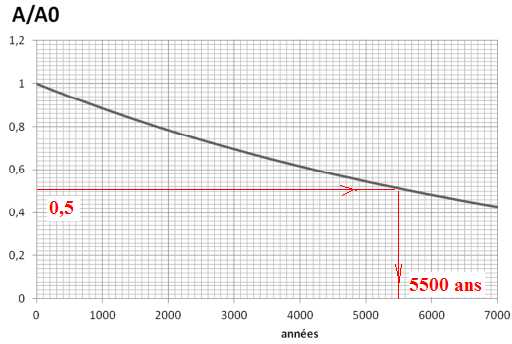
Au bout de deux demi-vies ( 11 000 ans), l'activité iitiale est divisée par quatre.
Le
prélèvement d’un crâne retrouvé dans un grenier parisien a fourni une
activité A au moment de la mesure (en juin 2013) telle que A = 12,8
désintégrations par minute et par gramme de carbone alors que
l’activité initiale peut être estimée à A0 = 13,5
désintégrations par minute et par gramme de carbone. Le crâne momifié
est supposé être celui du roi de France, Henri IV, né en 1553
et mort en 1610. Est-ce compatible ? Argumenter.
A / A0
= 12,8 / 13,5 =0,948. Le graphe ci-dessus, imprécis dans sa première
partie, indique environ 400 ans. C'est donc compatible.
|
|
|
L’eau gazeuse à la maison.
Certaines personnes fabriquent elles-mêmes leur eau gazeuse à partir d’eau du robinet et d’un système à dioxyde de carbone CO2(g). Le gaz injecté se dissout selon les équations suivantes :
CO2(g) + 2 H2O = HCO3-(aq) + H3O+ (1)
HCO3-(aq) + H2O = CO32-(aq) + H3O+ (2)
Dans l’équation (2), HCO3-(aq) et CO32-(aq) forment un couple acide-base. Qu’est-ce qu’un couple acide-base ?
Un couple acide base est constitué de deux espèces en équilibre telles que : acide = base + H+.
HCO3-(aq) = CO32-(aq) +H+aq.
Quel est l’acide et quelle est la base dans le couple étudié ?
HCO3-(aq) est l'acide, CO32-(aq) est la base.
La dissolution du dioxyde de carbone dans l’eau entraine une augmentation de la concentration des ions oxonium H3O+, également notés H+(aq). Comment évolue le pH de cette eau au cours de la dissolution ?
Si la concentration en ion oxonium augmente, le pH de la solution diminue.
CCiter un type de produit d’entretien couramment utilisé dans l’habitat qui possède également un pH « acide ».
Le détartrant pour cafetière.
|
.
|
|
Le dioxyde de carbone CO2 supercritique : un solvant non polluant.
Sélectionné
lors de l’exposition d’innovation technologique argentine INNOVAR 2012,
le lave-linge « Nimbus » est l’oeuvre de deux jeunes designers
industriels (Nicolás Araya et
Nicolás Vuksanovic) formés à
l’université nationale de Córdoba. S’inspirant d’expériences menées en
Europe, les deux inventeurs ont mis au point une machine capable de
laver le linge sans utiliser une seule goutte d’eau, grâce au CO2 supercritique.
Dans
ces conditions, le dioxyde de carbone se comporte comme un puissant
solvant, capable de dissoudre les taches et la saleté, sans endommager
le linge.
n souhaite éliminer, par solvant, une tache de graisse sur un tee-shirt. Plusieurs solvants sont disponibles.
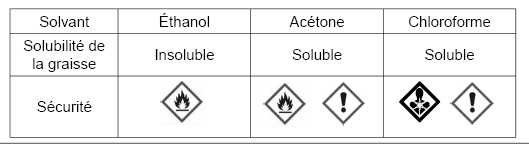
Parmi les solvants du document ci-dessus, indiquer celui que vous choisiriez et pourquoi vous écarteriez les deux autres ?
La graisse doit être soluble dans le solvant. Lle solvant ne doit pas être cancèrogène. On choisit donc l'acétone.
On peut également utiliser le dioxyde de carbone CO2 supercritique. L’état supercritique est un état de la matière, aux propriétés intermédiaires entre celles d’un gaz et celles
d’un
liquide (température > 31 °C et pression > 73 bars). Le processus
mis en jeu est décrit par le cycle suivant. Indiquer :
- dans les deux cases du graphique comportant des pointillés, l’état physique du dioxyde de carbone CO2, - et dans le tableau, la portion du cycle correspondant aux transformations décrites.
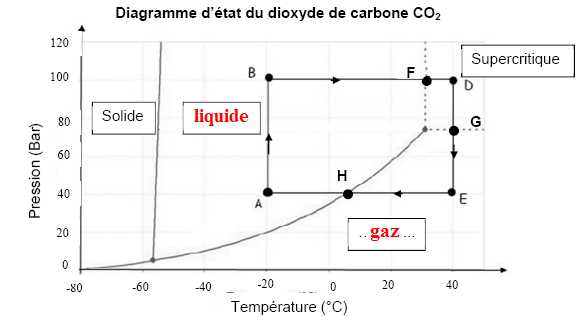
| Transformations | Graphiquement | | Le CO2 liquide est comprimé sous une centaine de bars | A---> B | | Le CO2 est chauffé de 31°C à 40°C à pression constante. Il est dans un état supercritique | F ---> D | | Dans l'extracteur, le CO2 se charge en graisse et sa pression diminue | D ---> G | | Le CO2 liquide est chauffé de -20°C à 31 °C à pression constante | B ---> F | | Le CO2 est détendu et se retrouve sous forme gazeuse, ce qui lui permet de se séparer de la graisse. | G ---> E |
.
|
|