Une piscine
naturelle chauffée. Bac
S Liban 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Étude du fluide caloporteur d’un chauffe-eau solaire.
La baignade est plus confortable si l’eau de la piscine est chauffée.
L’une des solutions possibles est d’installer un chauffe-eau solaire,
système qui permet de produire de l’eau chaude grâce à l’énergie
solaire. Le fluide caloporteur qui circule dans le capteur solaire est
un mélange d’eau et de mono propylène glycol ; c’est un antigel, dont
le nom en nomenclature officielle est
propane-1,2-diol et dont la formule topologique est la suivante :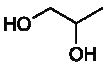
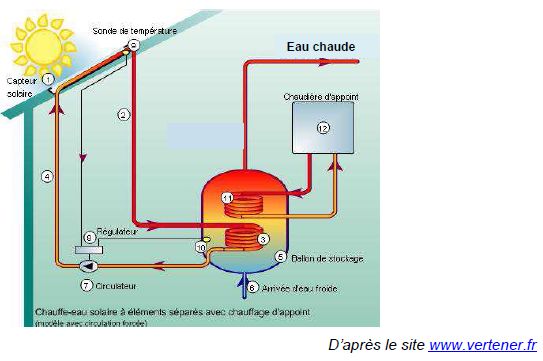
Quel
est le mode principal de transfert thermique mis en jeu entre le
capteur solaire (1) et le milieu extérieur ? En déduire la fonction de
la chaudière d’appoint.
Le capteur solaire convertit l'énergie solaire rayonnante en énergie thermique.
Ce dernier ne peut chauffer l'eau que durant les journées où il fait
grand soleil. La chaudière prend le relais quand il fait mauvais temps.
Quel est l‘intérêt pour le chauffe-eau solaire d’intégrer du mono propylène glycol dans la composition du fluide caloporteur ?
L'antigel incorporé à l'eau évite le gel du fluide en hiver.
Justifier le nom donné, en nomenclature officielle, au mono propylène glycol.
Trois atomes de carbone
sur la chaîne pincipale et deux groupes hydroxyle OH ( fonction alcool)
fixés sur les carbones n°1 et n°2.
Justifier le fait que la molécule de mono propylène glycol possède plusieurs stéréoisomères. Donner
la représentation de Cram de ces stéréoisomères et préciser le type de
stéréoisomérie qui les lie. Ces stéréoisomères sont-ils chiraux ?
Le carbone n°2 est asymétrique, il existe donc deux énantiomères, molécules chirales, image l'une de l'autre dans un miroir.
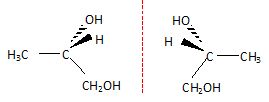
Comment réaliser un mélange racémique ?
Un mélange racémique contient 50 % de chaque énantiomère.
Déterminer le nombre de signaux que cette molécule présenterait en
spectroscopie RMN du proton, ainsi que la multiplicité de ces signaux.
On admettra que les protons des groupes –OH donnent le même signal et
ne se couplent pas avec les autres protons de la molécule.
Un signal singulet pour les deux protons des groupes OH.
Les trois protons du groupe méthyle CH3 sont couplés avec le proton du carbone n°2 : donc doublet.
Les deux protons du groupe CH2OH sont couplés avec le proton du carbone n°2 : donc doublet.
Le proton du carbone n°2 est couplé avec 5 protons portés par les carbones n°1 et n°3 : donc hexuplet.
|
| .
. |
|
|
Traitement de l’eau de la piscine.
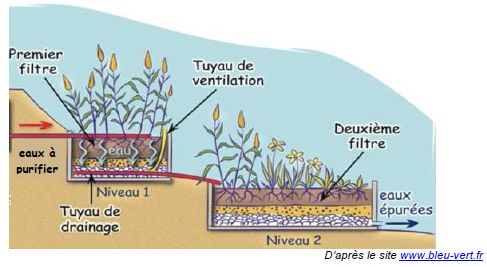
La technique de traitement de l’eau d’une piscine naturelle utilise les
bactéries présentes dans le système racinaire des plantes pour épurer
l’eau ; il s’agit d’une phyto-épuration. Les espèces végétales sont
ainsi soigneusement sélectionnées pour absorber des polluants tels que
les ions nitrate et phosphate. Une pompe de circulation assure le
déplacement de l’eau à travers la zone de filtration naturelle.
Schéma d’un système de phyto-épuration.
On se propose de tester l’efficacité d’un système de phyto-épuration de
ce type, en réalisant un dosage de l’azote total de la matière
organique contenue dans les eaux épurées à la sortie du dernier bassin.
On prélève un échantillon d’eau de volume Vech = 20,0 mL à la sortie du dernier
bassin et on met en oeuvre le protocole de dosage de l’azote total par
la méthode de Kjehldal. Le volume d’acide chlorhydrique versé à
l’équivalence est VE = 10,3 mL.
|
.
|
|
Protocole simplifié de dosage de l’azote total Kjeldahl.
Minéralisation : la transformation chimique se fait à une température
de 421°C en présence de sulfate de cuivre avec un excès d’acide
sulfurique. L’azote contenu dans la matière
organique est dégradé sous forme d’ions ammonium NH4+(aq) .
Distillation : un excès de soude est introduit dans le mélange obtenu
après minéralisation pour amener le pH de la solution à 12 et
transformer les ions ammonium en
molécules d’ammoniac NH3(aq), qui sont entrainées par la vapeur d’eau lors d’une distillation.
Titrage : le titrage de l’ammoniac NH3(aq) présent dans le distillat est réalisé par une solution d’acide chlorhydrique (H3O+ (aq), + Cl-(aq),), de concentration molaire Cac égale à
2,0 10-3 mol.L-1, jusqu’au virage d’un indicateur coloré bien choisi.
Quelle
propriété les transformations chimiques mises en jeu dans la méthode de
Kjeldahl doivent-elles toutes avoir pour que l’on puisse doser
l’intégralité
de l’azote présent dans l’échantillon ?
Les transformations doivent être totales.
Justifier le fait que NH4+(aq) et NH3(aq) forment un couple acide-base et préciser quelle est la forme acide et quelle est la forme basique.
Entre NH4+(aq) et NH3(aq) il existe un équilibre du type : NH4+(aq) = H+aq + NH3(aq).
La forme acide NH4+(aq) est suceptible de céder un proton ; NH3(aq) est la forme basique du couple acide / base.
Lors de l’étape de
distillation du protocole simplifié de dosage de l’azote total
Kjeldahl, pourquoi un pH égal à 8 pourrait-il ne pas convenir ?
pH=8 est inférieur au pKa de ce couple ( 9,2); à pH = 8 la forme ion ammonium prédomine alors que la forme NH3(aq) est minoritaire. Or c'est NH3(aq) qui doit être titrée.
Le suivi pHmétrique
du titrage de l’ammoniac par l’acide chlorhydrique dans des conditions
analogues, conduit au tracé du graphe représenté ci-dessous.
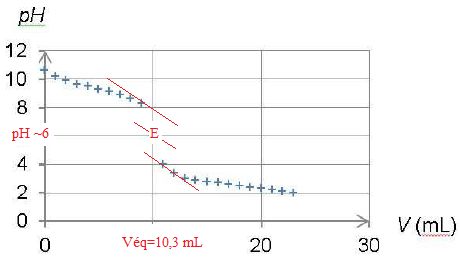
Quelle est l’espèce majoritaire dans le bécher au début du titrage ? Même question à la fin du titrage.
Le pH initial ( ~ 11) est bien supérieur au pKa du couple acide /base, la forme base NH3(aq) prédomine inituialement.
Le pH final ( ~ 2) est bien inférieur au pKa de ce couple : la forme NH4+(aq) prédomine à la fin du titrage.
En déduire l’équation de la réaction chimique support du titrage.
NH3(aq) + H3O+ (aq) ---> NH4+(aq) +H2O.
Citer un indicateur coloré à utiliser dans la méthode de Kjeldahl. Justifier.
La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent, soit pH=6 dans ce cas. Le bleu de bromothymol, le rouge de méthyle conviennent.
L’eau résiduaire est-elle conforme aux normes européennes en ce qui concerne l’azote total Kjeldahl ?
Quantité de matière d'ammoniac Cac Véq = 2,0 10-3 * 10,3 = 2,04 10-2 mmol dans 20 mL d'eau.
Concentration de l'ammoniac : 2,04 10-2 / 20 = 1,02 10-3 ~1,0 10-3 mol/L.
Masse d'azote correspondante : 1,02 10-3 * 14 ~1,4 10-2 g/L = 14 mg/L.
Cette valeur est inférieure à la norme N = 20 mg/L : l'eau résiduaire est donc conforme.
|
|