De
la couleur des nanoparticules.
Bac S Métropole 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Les
propriétés optiques de certains matériaux peuvent changer radicalement
lorsqu’ils sont réduits à l’état de particules de tailles plus petites
que les longueurs d’onde de la lumière visible. C’est le cas de l’or.
Ce
métal, jaune à l’état de pépite, donne une couleur proche du violet à
certains vitraux d’église, dans lesquels il se trouve sous forme de
nanoparticules dispersées. Encore plus surprenant, la couleur obtenue
dépend de la taille des particules.
Les chimistes ont développé de nombreuses techniques afin de produire
des nanoparticules d’or stables et de tailles diverses. La plus
utilisée est la méthode développée par John Turkévich en 1951. La
méthode de Turkévich propose de produire des nanoparticules d’or, métal
de symbole
Au, par réaction d’oxydoréduction entre une solution aqueuse d’ions tétrachloroaurate AuCl4- aq
et une solution aqueuse d’ions citrate C6H5O73-aq.
La solution d’ions tétrachloroaurate est dans un premier temps portée à
ébullition au moyen d’un montage à reflux, puis la solution d’ions
citrate est introduite par le haut du réfrigérant. Le reflux est
maintenu pendant plusieurs minutes sous vive agitation.
La réaction de Turkévich est modélisée par l’équation de réaction écrite ci-après :
2AuCl4- aq +3C6H5O73-aq ---> 2 Au(s) + 3 CO2 (aq) + 3 H+ (aq) + 8 Cl- (aq) + 3 C5H4O52-aqCette réaction est totale.
Remarque : outre les nanoparticules d’or, tous les produits formés lors de la réaction de Turkévich sont incolores.
On met en oeuvre la méthode de Turkévich à partir de deux mélanges différents de réactifs présentés dans le tableau ci-dessous :
| AuCl4- | C6H5O73-aq |
| Concentration
( mol/L ) | Volume
( mL) | Quantité de matière
( mmol) | Concentration
( mol/L ) | Volume
( mL) | Quantité de matière
( mmol) | | Mélange 1 | 2,5 10-4 | 250 | 6,25 10-2 | 3,4 10-2 | 1,4 | 4,76 10-2 | | Mélange 2 | 1,0 10-3 | 100 | 1,0 10-1 | 3,4 10-2 | 1,0 | 3,4 10-2 |
Déterminer le mélange qui permet d’obtenir une solution stable de nanoparticules d’or, puis indiquer la couleur de la solution obtenue en fin de réaction.
|
| .
. |
|
|
Une
trop faible quantité initiale d’ions citrate conduit à des solutions de
nanoparticules d’or instables. Lors de ses expériences, Turkévich a
obtenu des solutions stables de nanoparticules d’or uniquement lorsque
la quantité initiale d’ions citrate était supérieure au tiers de la
quantité nécessaire pour être dans les proportions stoechiométriques
avec les ions tétrachloroaurateinitialement introduits dans le mélange réactionnel.
Dans les conditions stoechiométriques, quantité de matière initiale d'ion citrate :
- mélange 1 : 6,25 10-2 *3 / 2 ~9,4 10-2 mmol ;
- mélange 2 : 0,10 *3 / 2 ~0,15 mmol.
Quantité de matière d'ion citrate égale au tiers de la quantité dans les conditions stoechiométriques :
- mélange 1 : 9,4 10-2 /3 ~ 3,1 10-2 mmol ;
- mélange 2 : 0,15 / 3 ~5,0 10-2 mmol.
Le mélange 1 remplit la condition pour obtenir des nanoparticules d'or stables.
|
|
|
Rapport
entre la quantité de matière initiale d’ions tétrachloroaurate et
la quantité initiale d’ions citrate ( mélange 1) : 6,25 / 4,76 ~1,3.
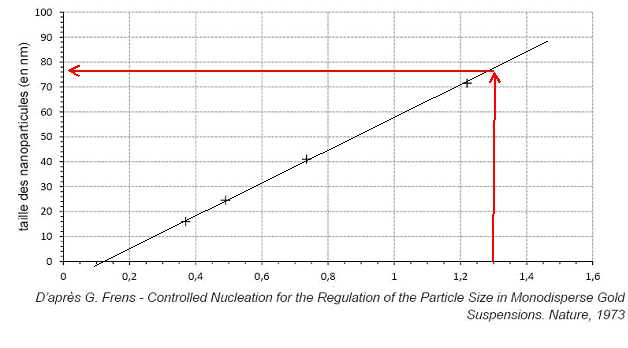
La taille des nanoparticules d'or est de l'ordre de 76 nm.
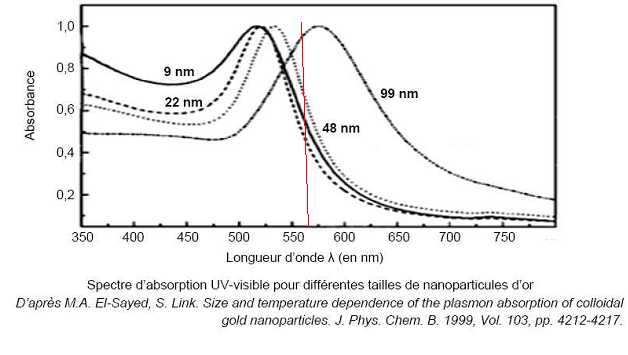
Les nanoparticules d'or présentent un maximum d'absorption vers 570 nm ( jaune vert). La solution obtenue a la teinte complémentaire du jaune, soit le rouge violacé.
|
|