La
chimie au service de la conservation du foin.
Bac S Métropole 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
L'acide
propionique peut servir d'agent de conservation en protégeant le foin
de la moisissure quand il est mis en balles à des teneurs en eau trop
élevées.
Identification de l’acide propionique.
Pour identifier l’acide propionique, on exploite les spectres IR et de RMN représentés ci-dessous.
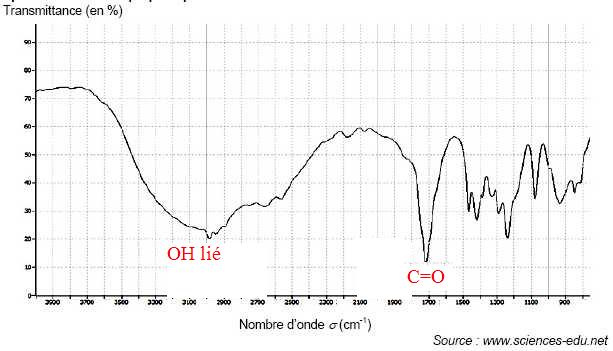
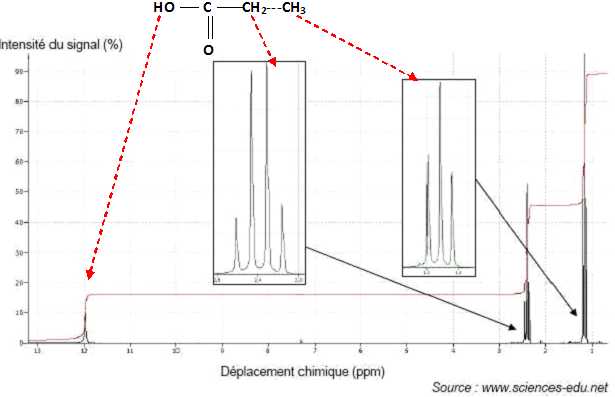
Pour
déterminer la structure de l’acide propionique, choisir la (ou les)
bonne(s) réponse(s) parmi les affirmations ci-dessous. Justifier à
l’aide de vos connaissances et des données.
L’acide propionique appartient à la famille des :
a. cétones.
b. aldéhydes.
c. acides carboxyliques. Vrai. La molécule contient le groupe COOH.
d. esters.
e. alcools.
L’acide propionique contient :
a. 2 atomes ou groupes d’atomes d’hydrogène équivalents.
b. 3 atomes ou groupes d’atomes d’hydrogène équivalents. Vrai. (voir spectre ci-dessus )
c. 4 atomes ou groupes d’atomes d’hydrogène équivalents.
|
| .
. |
|
|
Dans la molécule d’acide propionique, un atome ou groupe d’atomes d’hydrogène équivalents :
a. n’a pas d’hydrogène voisin. Vrai, le proton du groupe COOH
b. a un hydrogène voisin.
c. a deux hydrogènes voisins. Vrai, les protons du groupe CH3.
d. a trois hydrogènes voisins. Vrai, les protons du groupe CH2.
Une molécule d’acide propionique contient :
a. 5 atomes d’hydrogène.
b. 6 atomes d’hydrogène.Vrai. H3C-CH2-COOH.
c. 7 atomes d’hydrogène.
Identifier, en justifiant la réponse, la molécule d’acide propionique parmi les molécules suivantes.
Donner le nom de l’acide propionique dans la nomenclature officielle.
La valeur de la masse molaire moléculaire de l’acide propionique est-elle compatible avec votre choix.
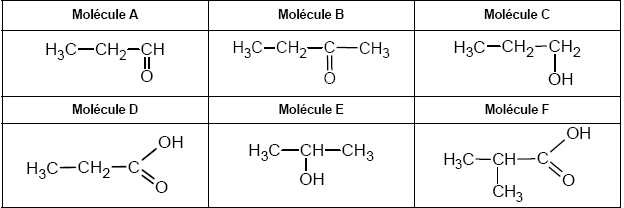
A, B, C et E sont exclues, elles ne comportent pas le groupe COOH.
F
ne correspond pas à la courbe d'intégration du spectre RMN de l'acide
propionique ; le spectre RMN de F comprend, entre autre, un doublet et
un sextuplet.
D est l'acide propanoïque.
M = 3*12+6+2*16=74 g/mol, valeur compatible avec le choix de D.
|
|
|
Utilisation de l’acide propionique.
Une
agricultrice rentre le foin produit sur une de ses parcelles
rectangulaires de 100 m sur 500 m. Elle doit le traiter à l’acide
propionique car son taux d’humidité est de 23%. Elle dispose en réserve
d’un volume de 150 L de solution d’acide propionique. On suppose que
l’utilisation de cette solution ne modifie pas le degré d’humidité du
foin.
Pour
savoir quelle quantité de solution pulvériser, il est nécessaire de
connaître la concentration de cette dernière en acide propionique. On
dose un volume V= 10 mL de cette solution diluée cent fois par une
solution d’hydroxyde de sodium de concentration molaire Cb=0,10 mol.L-1. La courbe obtenue lors du dosage par suivi pH-métrique est présentée ci-après :
En notant l’acide propionique HA et sa base conjuguée A-, la réaction support du titrage a pour équation : AHaq + HO-aq ---> A-aq + H2O.
Déterminer la concentration massique en acide propionique de la solution pulvérisée en explicitant la démarche suivie.
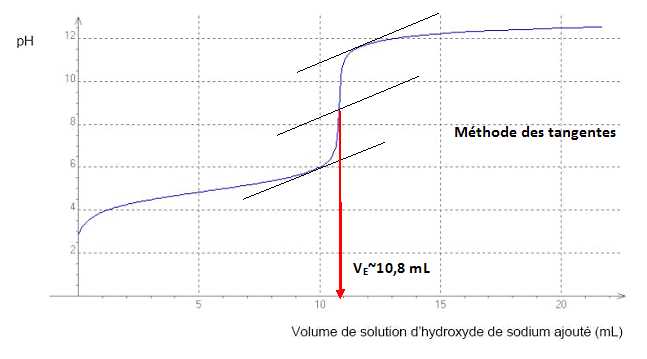
A l'équivalence CbVE =[AH] V ; [AH]= CbVE / V =0,10 *10,8 /10 = 0,108 ~0,11 mol/L.
Tenir compte de la dilution au centième : 100 *0,108 =10,8 ~ 11 mol/L.
Le
rendement de production du foin est de 7 tonnes par hectare. Elle
dispose de 150 L d'acide propanoïque en réserve. L’agricultrice
a-t-elle assez de solution pour traiter le foin produit par cette
parcelle ?
Pour un taux d'humidité de 23%, il faut 5 kg d'acide propanoïque par tonne de foin.
Surface de la parcelle : 100 *500 = 5,0 104 m2 =5,0 ha.
Masse d'acide propanoïque nécessaire : 5 *7*5 =175 kg.
Masse d'acide propanoïque en réserve : 150*10,8 ~1620 mol soit en masse : 74 *1620 ~1,2 105 g 1,2 102 kg.
La réserve est insuffisante.
|
|