L'ocytocine,
une hormone peptidique de synthèse.
Bac S Métropole 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
L’ocytocine
est un polypeptide constitué à partir de neuf acides -aminés tels que
la cystéine (Cys), la proline (Pro), l'asparagine (Asn), la glycine
(Gly), la leucine (Leu)…
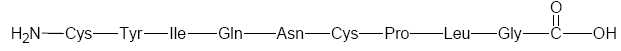
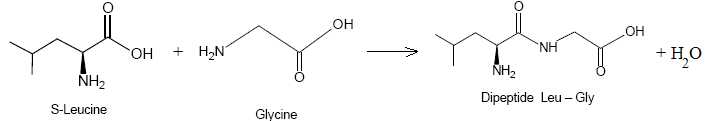
La première étape de la synthèse de l'ocytocine correspond au couplage de deux acides a-aminés : la glycine (par son groupe – NH2) avec la leucine (par son groupe –COOH). Ce couplage permet de former le dipeptide Leu – Gly.
L'un des principaux problèmes rencontré lors de cette synthèse réside
dans le fait que l'on souhaite synthétiser exclusivement le dipeptide
Leu – Gly et non les dipeptides résultant d'autres combinaisons entre
la glycine et/ou la leucine. Certains groupes d'atomes de la glycine et
de la leucine doivent donc être momentanément protégés afin de procéder
au couplage des deux acides a-aminés. Une fois le produit de ce couplage formé :
-
soit le chimiste souhaite limiter la synthèse à la préparation du
dipeptide Leu – Gly et il procède alors à la déprotection de ce
dipeptide ;
- soit il poursuit la synthèse de l'ocytocine en faisant
une déprotection adaptée et en additionnant successivement les autres
acides a-aminés, puis il procède à la déprotection finale.
Structure du dipeptide Leu – Gly.
Après avoir écrit la formule semi-développée du dipeptide Leu – Gly obtenu, entourer tous les groupes
caractéristiques
qu'il renferme et nommer les familles chimiques correspondantes. Le
dipeptide Leu – Gly représenté peut-il être qualifié de molécule
chirale ? Justifier.
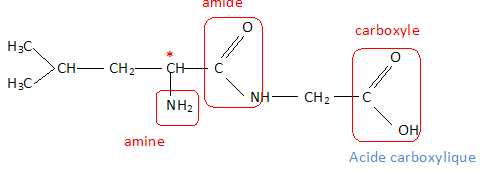
L'existence d'un atome de carbone asymétrique conduit à l'existence de deux énantiomères. La molécule est chirale.
|
| .
. |
|
|
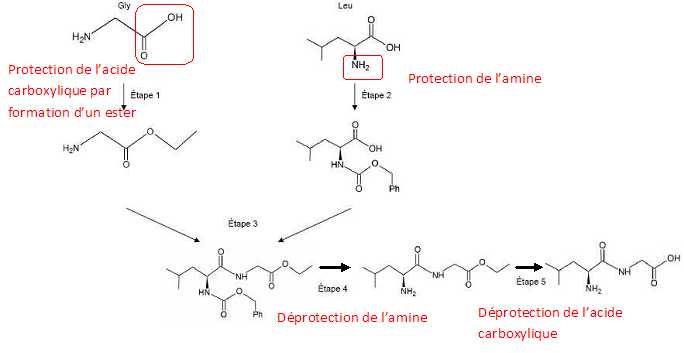
Étude de la synthèse du dipeptide Leu – Gly.
La
synthèse du dipeptide nécessite une protection préalable de certains
groupes caractéristiques de la glycine et de la leucine. Le document 1
présente la succession simplifiée des étapes de la synthèse de ce
dipeptide. Recopier les formules de la S-leucine et de la glycine puis
entourer sur chacune d’elles le (ou les) groupe(s) caractéristique(s)
nécessitant une protection.
Identifier la (les) étape(s) de la
synthèse du dipeptide Leu – Gly correspondant à des étapes de
protection. Dans chaque cas, préciser quel acide a-aminé est concerné.
Identifier la (les) étape(s) de la synthèse du dipeptide Leu – Gly correspondant à des étapes de déprotection.
Quel est le nom de la famille chimique correspondant au groupe caractéristique formé à l’étape 1 ?
|
|
|
Combien
de dipeptides différents aurait-on pu obtenir à partir de la glycine et
de la leucine si l'on n'avait pas eu recours à la protection des
groupes caractéristiques ?
On aurait pu obtenir 4 dipeptides : Leu - Leu ; Leu-Gly ; Gly - Gly ; Gly - Gly.
Le mécanisme réactionnel de l’étape 1 de la synthèse du dipeptide Leu – Gly est présentéci dessous.
La glycine y est notée sous la forme simplifiée R-COOH. À quoi correspond le groupe R ? H2N-CH2.
Recopier
les étapes 1a et 1c du mécanisme réactionnel et les compléter afin de
justifier la formation et la rupture des liaisons.
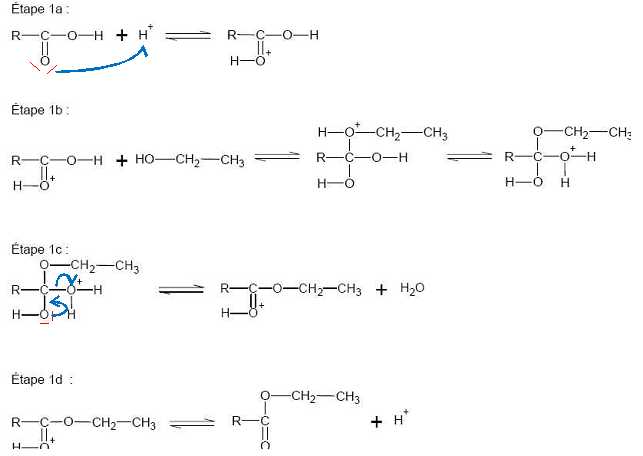
Quel est le rôle des ions hydrogène H+ intervenant dans l'étape 1 de la synthèse du dipeptide ? Justifier.
H+ est un catalyseur : il intervient dans l'étape 1a en tant que réactif ; il est régénéré lors de l'étape 1 d.
|
|