L'éthanoate
de linalyle et le linalol.
Bac S Asie 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Le
linalol et l’éthanoate de linalyle sont des composés odorants
principalement utilisés pour les parfums, cosmétiques, savons,
…Principales espèces chimiques présentes dans la lavande fine et
du lavandin, elles peuvent être extraites de ces fleurs par
hydrodistillation. Elles peuvent aussi être synthétisées. Le linalol
est obtenu à partir de la propanone et l’éthanoate de linalyle est
obtenu à partir du linalol.
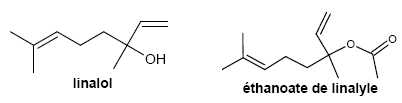
Les molécules d’éthanoate de linalyle et de linalol.
Sur
la formule topologique de la molécule d’éthanoate de
linalyle, entourer le(s) groupe(s) caractéristique(s) et nommer la
(ou les) famille(s)chimique(s) correspondante(s).
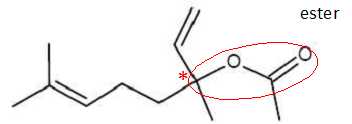
Lors de la synthèse de l’éthanoate de linalyle à partir du linalol racémique, on obtient un
mélange de plusieurs stéréoisomères.
La molécule d’éthanoate de linalyle possède-t-elle des carbones asymétriques ? Justifier et
les indiquer, à l’aide d’un astérisque, sur la formule topologique donnée.
Un atome de carbone asymétrique est tétragonal et lié à 4 atomes ou groupes d'atomes différents. La molécule d’éthanoate de linalyle possède un atome de carbone asymétrique.
La molécule d’éthanoate de linalyle présente-t-elle une diastéréoisomérie de type Z/E ? Justifier la réponse.
Non. Pour la double liaison C=C(CH3)2 , l'un des atomes de carbone porte deux groupes identiques. Pour la double liaison C=CH2 , l'un des atomes de carbone porte deux atomes d'hydrogène. Donner, en conclusion, le type de stéréoisomèrie présent dans le mélange obtenu lors de la
synthèse.
Le mélange obtenu contient un couple d'énantiomères.
Le linalol a pour nom systématique : 3,7-diméthylocta-1,6-dièn-3-ol. Justifier ce nom en précisant le raisonnement suivi.
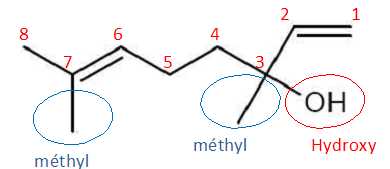
La
chaine principale compte 8 atomes de carbone. Le groupe hydroxy (
fonction alcool) est portée par le carbone n°3. Les deux groupes
méthyle sont portés par les carbones n°3 et 7.
Les deux doubles laisons C=C sont en position 1 et 6.
|
| .
. |
|
|
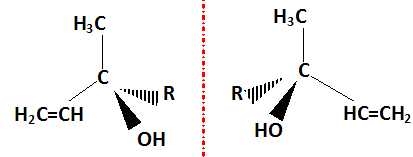
Identifier le groupement R qui apparaît dans la formule simplifiée du linalol ci-dessous.

La molécule de linalol présente deux énantiomères. Donner la représentation de Cram de
ces deux énantiomères en utilisant la formule simplifiée ci-dessus.
|
.
|
|
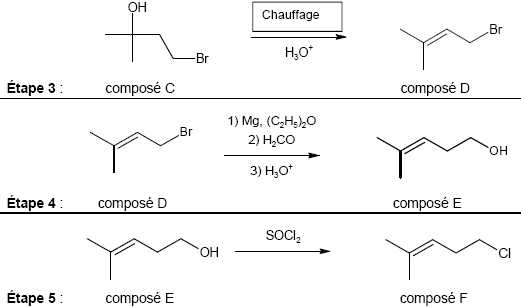
Associer
aux étapes 3 et 5 de la synthèse, en justifiant votre choix, une
catégorie de réaction parmi les catégories suivantes : élimination,
addition, substitution.
Etape 3 : déshydratation d'un alcol, élimination d'une molécule d'eau.
Etape 5 : substitution , remplacement du groupe hydroxy OH par un chlore.
Pour
les étapes 4 et 5 de la synthèse, indiquer s’il s’agit d’une
modification de chaîne et/ou d’une modification de groupe
caractéristique.
Etape 4 : la chaine carbonée principale est modifiée, elle compte un atome de carbone de plus.
Etape 5 : modification du groupe caractéristique : OH est remplacé par Cl.
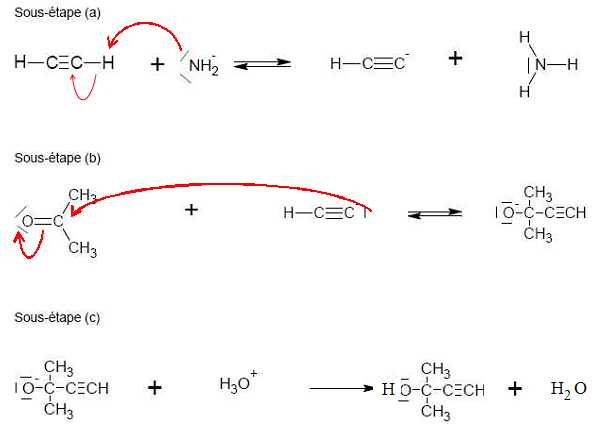
Le
mécanisme réactionnel de l’étape 1 est donné. Compléter le mécanisme
des sous-étapes (a) et (b) avec les flèches courbes et les doublets non
liants. Indiquer les produits formés manquants dans la sous-étape (c).
Le
spectre infrarouge du produit obtenu lors de l’étape 6 est représenté
ci-dessous. Quel (s) élément(s), dans ce spectre, permet(tent) de
montrer sans ambiguïté, qu’il y a bien eu formation de linalol lors de cette étape ?
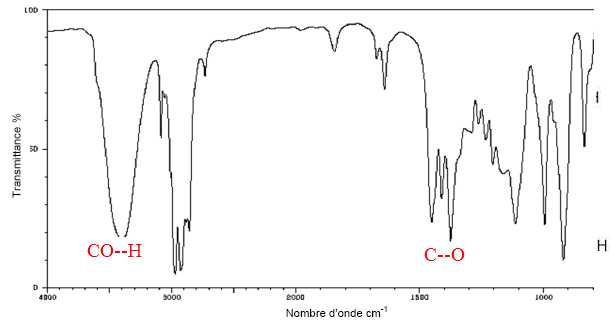
OH alcool lié par liaison hydrogène : large bande vers 3200 cm-1. Liaison C--O, bande vers 1400 cm-1.
|
Différentes méthodes pour synthétiser l’éthanoate de linalyle.
Il
existe plusieurs méthodes pour synthétiser l'éthanoate de linalyle. On
peut faire réagir le linalol soit avec un acide carboxylique soit avec
un anhydride d'acide.
Première méthode : obtention de l’éthanoate de linalyle à partir de l’acide éthanoïque.
Pour
obtenir de l’éthanoate de linalyle, on chauffe à reflux du linalol avec
un excès d'acide éthanoïque, en présence d'acide sulfurique. On
obtient, après séparation, rinçage et
séchage, l'éthanoate de linalyle. Le rendement de cette synthèse, modélisée ci-dessous, est de 5 %.
linalol + acide éthanoïque éthanoate de linalyle + eau
Écrire l’équation de la réaction de synthèse.
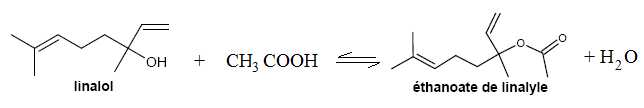
Quel est le rôle d’un chauffage à reflux ?
Le
chauffage à reflux permet d'accélérer la réaction sans perte de
matière, les vapeurs se condensent dans le réfrigérant et retombent
dans le milieu réactionnel.
L’acide sulfurique joue le
rôle de catalyseur. Parmi les caractéristiques d’une transformation
chimique, proposées ci-après, indiquer celle(s) qui est (sont)
modifiée(s) par ajout d’un catalyseur :
la cinétique, la composition finale du mélange, le mécanisme réactionnel.
La cinétique et le mécanisme réactionnel sont modifiés.
Deuxième méthode : obtention de l’éthanoate de linalyle à partir de l’anhydride éthanoïque.
On
réalise le chauffage à reflux de V=10,0 mL de linalol et d’un excès
d’anhydride éthanoïque. On obtient, après séparation, rinçage et
séchage, 8,4 g d’éthanoate de linalyle. Cette transformation,
modélisée ci-dessous, est rapide.

Indiquer les précautions à prendre lors de cette synthèse. Justifier.
L'anhydride éthanoïque
est un liquide inflammable, toxique par inhalation et ingestion,
provoquant des brûlures de la peau et des lésions oculaires.
Port de blouse, gants et lunettes de protection ; travail sous hotte loin de toute flamme.
Déterminer le rendement de cette synthèse.
On calcule le rendement à partir du réactif limitant, le linalol ( densité d = 0,87 ; M = 154 g/mol ).
Quantité de matière de linalol n = V d / M = 10,0 *0,87 / 154 =5,65 10-2 mol.
Quantité de matière d'éthanoate de linalyle : n = 5,65 10-2 mol.
Masse théorique d'éthanoate de linalyle : mth=n M(éthanoate de linalyle) =5,65 10-2 *196 =11,07 g.
Rendement : masse expérimentale / masse théorique = 8,4 / 11,07 =0,76 ( 76 %).
En
fin de synthèse, on réalise le spectre R.M.N. du proton du produit
obtenu, afin de s’assurer qu’il s’agit bien de l’éthanoate de linalyle.
Quel(s) changement(s) (nombre et multiplicité des
signaux, courbe d’intégration) va-t-on observer sur le spectre du produit obtenu par rapport à celui du linalol ?
On doit retrouver le
signal caractéristique du groupe méthyle en alpha d'un groupe C=O. (
singulet vers 1,5 ppm, intégrant pour 3 protons ).
Le singulet du proton du groupe OH disparaît.
D’après les informations fournies, comparer les deux méthodes proposées pour synthétiser l'éthanoate de linalyle.
La première méthode conduit à un rendement dérisoire.
La seconde, bien qu'elle utilise un réactif dangereux, est rapide est aboutit à un rendement satisfaisant. |
|
|