Chimie et
modèlisme.
Bac S
Antilles 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Questions préalables :
Recopier et compléter le schéma permettant de réaliser l’anodisation des quatre bras du drone.
Vous représenterez la cuve à électrolyse, les électrodes en précisant
sur quelle électrode se trouvent les quatre bras à anodiser.
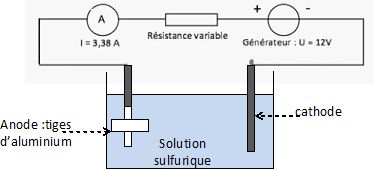
A l'anode, reliée au pôle positif du générateur, se produit une oxydation.
Problème :
Déterminer la durée de l’électrolyse qui permettra au modéliste de protéger au mieux les quatre bras de son drone.
Bras : 320 mm de tube plein à section carrée en aluminium anodisé (4 pièces).

Masse volumique de l’alumine : r(Al2O3) = 3,97 g.cm-3.
L’anodisation sulfurique d’une pièce d’aluminium par immersion complète
permet un dépôt d’alumine de 10 à 20 micromètres.Surface latérale d'un bras : 32*4*1,2 = 153,6 cm2.
Surface des deux bouts : 2*1,22 =2,88 cm2.
Surface totale d'un bras : 153,6+2,88 = 156,48 cm2.
Surface totale des quatre bras : S= 4*156,48 =625,92 cm2.
Volume d'alumine pour une épaisseur e = 20 µm = 2,0 10-3 cm.
V = S e = 695,92 *2,0 10-3 = 1,39 cm3.
Masse d'alumine : m = V r(Al2O3) =1,39 *3,97 =5,5256 ~5,53 g.
|
| .
. |
|
|
M(alumine) = 27*2+3*16 = 102 g/mol.
Quantité de matière d'alumine n = m / M(alumine) = 5,526 / 102 = 5,417 10-2 mol.
Equation de la réaction d’oxydation de l’aluminium :
2 Al + 3 H2O → Al2O3 + 6 H+ + 6 e–.
Quantité de matière d'électron : 6n = 5,417 10-2 *6 =0,325 mol.
Quantité de matière d'électricité : Q = 6 n F = 0,325 *96500 = 3,137 104 C.
Intensité du courant I = 3,38 A.
Durée de l'anodisation : t = Q / I = 3,137 104 / 3,38 ~ 9,28 104 s ou ~ 155 min ou 2 h 35 min.
Pour un dépôt de 10 µm, la durée serait de moitié.
|
|