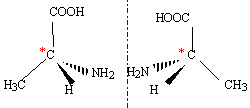Chimie et cuisine.
Bac S
Antilles 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Justifier que l’alanine soit un
acide aminé. Justifier
le fait que l’alanine possède des stéréoisomères. Donner une
représentation de Cram de chacun de ces stéréoisomères. Préciser le
type de relation, énantiomérie ou diastéréoisomérie,entre ces
stéréoisoméres.
L'alanine
possède unes fonction amine et une fonction acide carboxylique.
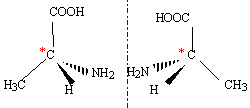
Le carbone asymétrique ( carbone
tétragonal lié à 4 groupes différents ) est responsable de l'isomérie
optique. Il existe donc deux énantiomères.
Un des mécanismes proposé pour la « réaction » de Maillard fait
intervenir trois étapes. Identifier, en justifiant votre réponse, les
sites donneurs et accepteurs de doublets d'électrons présents dans les
molécules de glucose et d’alanine représentées dans le mécanisme.
L'atome d'azote du groupe
amine, porteur d'un doublet électronique, dans
l'alanine, est donneur
d'électrons. L'atome de
carbone du groupe carbonyle, dans la fonction aldehyde du
glucose, est déficitaire en électrons. Ce carbone est accepteur d'électrons.
Recopier et compléter les étapes 1 et 3 avec une ou plusieurs flèches
courbes pour rendre
compte de ces étapes.2.3. Donner la formule de l’espèce chimique A
intervenant dans l’étape 3.

|
| .
. |
|
|
Dans le but d’étudier et d’optimiser la «
réaction » de Maillard, on effectue un suivi en laboratoire de la réaction conduisant aux mélanoïdines afin de déterminer les
facteurs qui influencent sa cinétique.
Étude expérimentale. Produits, solutions :
glucose solide ; alanine solide ; solution tampon phosphate : pH = 7,8
; solution tampon acétique pH = 4,8 ; solution de glucose de
concentration molaire c, dans chacune des solutions tampon ;
solution d’alanine de concentration molaire c, dans chacune des
solutions tampon.
Lors des expériences, plusieurs tubes à essais fermés contenant un
mélange équimolaire (solide ou en solution) de glucose et d’alanine ont été préparés et placés dans
un bain-marie.
Différents paramètres ont été modifiés ou différentes substances ont
été ajoutées, en fonction du facteur à tester.
Pour suivre l’évolution de la « réaction » de Maillard, une fois le
tube à essais sorti de l’eau du bain-marie, on le plonge dans un bain eau - glace.
On introduit ensuite une partie du mélange dans la cuve d’un
spectrophotomètre réglé sur une longueur d’onde de 420 nm. On relève l’absorbance A du mélange.
Les résultats obtenus pour chaque
expérience sont retranscrits ci-dessous sous forme de
graphiques :
Expérience 1
: mélange équimolaire de glucose et d’alanine dans une solution tampon
phosphate, 80 min de chauffage à différentes températures.

|
|
|
Expérience 2 : mélange
équimolaire de glucose et d’alanine à la température 80°C.

Expérience 3
: mélange équimolaire à 2,0 x 10-3 mol de glucose solide et
d’alanine solide dissous dans différents volumes d’eau (Veau
rajoutée), 80 min de chauffage à la température de 80°C.

Avant chaque analyse, les tubes à essais sont plongés dans un bain eau
- glace. Quel est le rôle de cette opération ?
Cette opération réalise
un blocage cinétique.
Justifier qualitativement le fait que des mesures d’absorbance
permettent de suivre l’évolution de la « réaction » de Maillard.
Les mélanoïdes sont les
seules espèces colorées ( jaune orangée). Elles présentent un maximum
d'absorption dans le bleu, couleur complémentaire du jaune
orangé. Plus la coloration des mélanoïdines est importante, plus le
processus est avancé.
|
À
l’aide des résultats expérimentaux, et en justifiant les réponses,
déterminer les facteurs qui influent sur la « réaction » de Maillard et
décrire leurs actions.
Expérience 1 : la
température est un facteur cinétique.
Expérience 2
: la réaction est favorisée par un
milieu tamponé à pH = 7,8, alors qu'lelle est très défaforisée en
milieu acide. La réaction
dépend du pH.
Expérience 3
: l'eau est indispensable à certaines
étapes mais elle est aussi l'un des produits ; la réaction est optimale
pour un volume d'eau de 0,15 mL soit pour une concentration en glucose
et alanine voisine de : 2,0 10-3 /(0,15 10-3)
~13 mol/L.
La réaction est limitée
par l'hydrolyse de la mélanoïdine.
Déterminer les masses des réactifs et d’eau à prélever pour réaliser le
mélange équimolaire et avoir une réaction optimale à 80°C. Déterminer
le pourcentage massique d’eau.
Volume d'eau : 0,15 mL
soit 0,15 g.
Masse de glucose : 2,0 10-3
*180 =0,36 g ; masse d'alanine : 2,0 10-3
*89 ~0,18 g ;
% massique d'eau : 0,15 /(0,15 +0,36+0,18) =0,22 ( 22 %).
À l'aide du mécanisme réactionnel, expliquer pourquoi la « réaction »
de Maillard est favorisée par un pH supérieur à 11. On pourra s’aider
d’un diagramme de prédominance.
On donne les pKa des couples acide base auquel appartient l'alanine : pKa1 = 2,3 , pKa2 = 9,7.
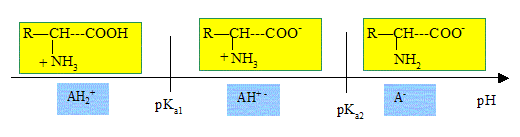
A un pH
supérieur à pKa2 = 9,7, la fonction amine est sous forme NH2
et le doublet de l'azote est disponible alors qu'à pH inférieur à 9,7 NH2 est majoritairement sous forme +NH3. Lors de la première étape, ce doublet attaque le carbone du groupe carbonyle du glucose.
En quoi la « réaction » de Maillard permet d’expliquer qu’un aliment
doré à la poêle n’a pas le même aspect ni le même goût que le même
aliment cuisiné à la vapeur ?
En cuisant des aliments à une température élevée dans un four ou dans
une poêle beurrée, on crée facilement des composés mélanoïdiques
intéressants du point de vue du goût et des arômes. Lors de la cuisson à la vapeur ( la température est modérée environ
100°C ), la vapeur d'eau se condensent sur les aliments. Si l'eau est
en quantité trop importante, la formation de mélanoïdines est très faible ( expérience 3 ).
|
|
|