Contrôle d'un vin,
teneur en fer, acidité. Bac S Centres étrangers 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Détermination
de la teneur en fer d'un vin.
Afin de déterminer la concentration totale en ions Fe2+(aq)
et Fe3+(aq) dans ce vin blanc, on oxyde lesions Fe2+(aq)
en ions Fe3+(aq) à l’aide d’eau oxygénée H2O2,
puis on dose la totalité des ions Fe3+(aq) par
spectrophotométrie après les avoir fait réagir totalement avec une
solution aqueuse de thiocyanate depotassium. La mesure de l’absorbance
de la solution obtenue pour une longueur d’onde l = 465 nm vaut A = 0,760.
Quelle opération est-il nécessaire de réaliser avant de mesurer
l’absorbance de l’échantillon ?
Il faut faire le blanc, mesurer l'absorbance d'une solution ne
contenant pas l'espèce colorée, correspondant à une absorbance de
référence nulle.
Pourquoi
est-il nécessaire de faire réagir les ions Fe3+ (aq) avec
les ions thiocyanate avant de
réaliser le dosage spectrophotométrique ?
L'ion fer (III) a une
coloration jaune pâle ; par contre complexé avec l'ion thiocyanate, il
présente une coloration rouge foncé. Ce complexe possède un maximum
d'absorption vers 465 nm.
En utilisant les données et les résultats de cette analyse, indiquer si
le phénomène de casse
ferrique peut se produire pour ce vin blanc. Expliciter votre démarche.
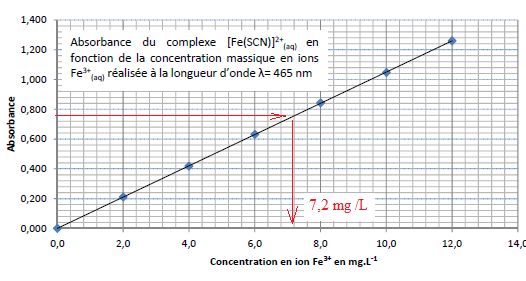
La casse ferrique ne se
produit pas, la teneur en fer étant inférieure à 10 mg/L.
Détermination
de l’acidité totale du vin.
Dans la réglementation européenne, l'acidité totale correspond à la
masse équivalente d’acide
tartrique par litre ; c’est à dire la masse d’acide tartrique qui
nécessiterait la même quantité de base pour ramener son pH à 7. Pour déterminer l’acidité totale, on mesure le
volume de solution aqueuse d’hydroxyde de sodium qu’il faut ajouter à un volume V de vin, préalablement
décarboniqué, pour ramener son pH à 7. Après avoir décarboniqué le vin
(élimination du dioxyde decarbone), on titre un volume V = 10,00 ± 0,04 mL de vin par une
solution aqueuse d’hydroxyde de
sodium de concentration molaire CB = (4,2 ± 0,2)×10-2 mol.L-1 en
présence de quelques gouttes de bleu de bromothymol. L’équivalence est repérée pour un volume versé VE = 15,5 mL.
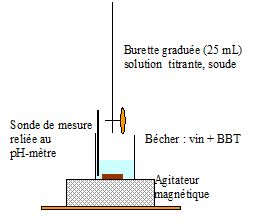
Faire un schéma annoté du montage à réaliser pour effectuer le titrage et préciser la verrerie à
utiliser pour prélever le volume V de vin.
Le volume précis de vin est prélevé à l'aide d'une pipette jaugée de 10,00 mL.
|
| .
. |
|
|
Estimer l’incertitude sur la mesure de UVE sachant que la verrerie contenant la solution aqueuse
d’hydroxyde de sodium est graduée tous les 0,1 mL.
UVE =2* 0,5 *0,1 = 0,1 mL.
Justifier la nécessité de l’opération préalable de décarbonication pour déterminer l’acidité totale
du vin.
Le dioxyde de carbone dissout est un acide faible. Il faut l'éliminer sinon le titrage de l'acidité du vin sera faussé.
Dans l’hypothèse où l’acidité du vin est due au seul acide tartrique noté H2A(aq), l’équation de la
réaction support de titrage s’écrit :
H2A(aq) + 2HO-aq --> A2-aq +2H2O(l)
Montrer que la concentration massique Cm en acide tartrique équivalent dans le vin est donnée par la relation : Cm= CB. VE .M /(2 V) où M=150 g/mol désigne la masse molaire de l’acide tartrique.
A l'équivalence :
quantité de matière d'ion hydroxyde : CB. VE ;
quantité de matière d'acide tartrique : V C.
Compte tenu des nombres stoechiométriques, à l'équivalence : CB. VE = 2 CV
C = CB. VE / (2V) mol/L ; Cm= CB. VE .M /(2 V) g /L.
Cm=4,2 10-2 *15,5 / 20 *150 =4,88 ~4,9 g/L.
|
.
|
|
Donner un encadrement de la valeur de la concentration massique.
UCm = 2 Cm [(UCb /CB)2+(UVE /VE)2+(UV /CV)2 ]½ ;
UCm = 2 *4,9 [(0,2 /4,2)2+(0,1 /15,5)2+(0,04 /10)2 ]½ = 2*4,9 *4,8 10-2 =0,47 ~0,5.
UCm =(4,9 ±0,5 ) g/L.
Un vin de table est propre à la consommation si son acidité totale ne dépasse pas 9,0 g.L-1 d’acide tartrique équivalent.
|
|