Synthèse de
l'hélianthine. Bac S Centres étrangers 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Première étape
de la synthèse de l’hélianthine
La synthèse de l’hélianthine comporte deux étapes :
· une réaction de diazotation de l’acide sulfanilique,
· une réaction de copulation sur la N,N-diméthylaniline.
La première étape est une réaction de diazotation entre l’acide
sulfanilique et l’acide nitreux dont
l’équation est la suivante :
HO3S – C6H4 – NH2 + HNO2
+ H3O+ → HO3S – C6H4
– N2+ + 3 H2O
acide sulfanilique acide
nitreux
ion aryldiazonium
Le protocole de cette étape est décrit ci-dessous :
Préparation de la
solution d’acide sulfanilique.
Dans un erlenmeyer de 100 mL, introduire 1,0 g d’acide sulfanilique pur
sous forme solide.
Ajouter 20 mL d’eau.
Refroidir cette solution dans un bain eau-glace et mettre sous
agitation durant 5 minutes.
Préparation de
l’acide nitreux.
Dans un erlenmeyer de 100 mL, introduire 10 mL d’une solution
aqueuse de nitrite de sodium
(Na+(aq) + NO2-(aq)) de concentration
molaire égale à 2,0 mol.L-1 et refroidir cette solution dans
un
bain eau - glace.
Ajouter 20 mL d’acide chlorhydrique (H3O+(aq) + Cl-(aq))
de concentration molaire égale à
2,0 mol.L-1.
Diazotation.
Ajouter la solution précédente goutte à goutte à la solution d’acide
sulfanilique.
Choisir parmi les trois termes suivants celui qui qualifie l’étape de
préparation de la solution d’acide sulfanilique : addition,
dissolution, dilution.
Dissolution d'un solide
dans l'eau.
L’acide nitreux est instable. Il est donc préparé à froid et
juste avant utilisation par action de l’acide
chlorhydrique sur le nitrite de sodium.
Quelles précautions doit-on prendre pour manipuler la solution de
nitrite de sodium ?
Le nitrite de sodium est
un poison ; c'est un comburant et il est dangereux pour l'environnement.
Port de blouse, gants et
lunettes de protection ; ne rien jeter à l'évier.
Parmi la verrerie proposée ci-dessous, laquelle
semble la plus adéquate pour mesurer le volume
de 20 mL de la solution d’acide chlorhydrique ?
«bécher 100 mL» ; «pipette jaugée 20 mL» ; «éprouvette graduée 25 mL» ;
«fiole jaugée 20 mL».
Ce volume n'étant pas
très précis, utiliser une éprouvette graduée de 25 mL.
Sachant que cette transformation est totale, écrire l’équation de la
réaction de formation de
l’acide nitreux et préciser la nature de cette réaction.
NO2-(aq)
+H3O+(aq)
--> HNO2(aq) +H2O(l).
Montrer
que la valeur de la quantité de matière d’acide nitreux formé lors de
sa préparation
est égale à 2,0 × 10-2 mol.
Quantité de matière d'ion
nitrite = quantité de matière d'acide nitreux .
n= 10*2,0 = 20 mmol = 2,0 10-2 mol.
Quel est
le réactif en défaut dans l’étape de diazotation ? En déduire la
quantité d’ions
aryldiazonium formés.
Quantité de matière
d'acide sulfanilique : m / M(acide sulfanilique) = 1,0 / 173,1~5,8 10-3 mol.
L'acide nitreux et
l'acide sulfanilique réagissent mole à mole : l'acide sulfanilique est
en défaut.
Il se forme 5,8
10-3 mol d’ions aryldiazonium.
|
| .
. |
|
|
Les couleurs de
l’hélianthine.
L’hélianthine se trouve, selon le pH, sous forme acide notée HIn et/ou
sous forme basique notée In-.
Ces deux formes ont des couleurs différentes en solution aqueuse. HIn
et In- constituent un couple
acide/base dont le pKa est égal à 3,7.
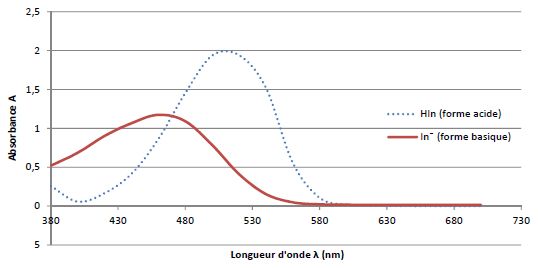
Les spectres UV-visible des formes acide et basique de l’hélianthine
sont représentés ci-dessous :
On introduit quelques gouttes d’hélianthine dans une solution aqueuse
incolore de pH égal à 5.
Quelle couleur prend cette solution ? Décrire votre démarche en
utilisant les données et vos
connaissances.
A pH inférieur au pKa,
la forme acide HIn prédomine. HIn présente un maximum d'absorption vers
520 nm ( vert). La solution a la couleur complémentaire du vert, c'est
à dire le rouge.
L’hélianthine présente sa teinte sensible, résultat de la
superposition de sa forme acide et de sa
forme basique, dans une zone de pH appelée zone de virage.
On considère, en première approximation, que l’on a superposition des
teintes quand aucune des
deux formes n’est prépondérante devant l’autre : c’est-à-dire si aucune
n’a sa concentration
supérieure à dix fois celle de l’autre. Déterminer la zone de virage.
Expliciter la démarche.
pH = pKa
+log [In-] / [HIN].
Si [In-] /
[HIN] = 10; pH maxi = 3,7 +1 = 4,7 ; Si
[In-] / [HIN] = 0,1 ; pH mini = 3,7 -1 = 2,7.
En réalité, il faut prendre en
compte l’intensité de la teinte de chaque forme ; la zone de virage
réelle de l’hélianthine est de ce fait comprise entre pH = 3,1 et pH =
4,4.
|
.
|
|
Titrage
colorimétrique.
On réalise le titrage suivi par pH-métrie d’une solution aqueuse
d’acide benzoïque C6H5COOH par une solution
aqueuse d’hydroxyde de sodium (Na+ (aq) +HO-(aq)).
La courbe du titrage suivante présente les variations du pH en fonction
du volume de solution aqueuse d’hydroxyde de sodium versé.
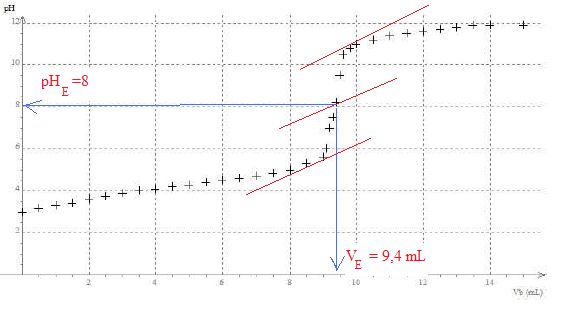
Aurait-on pu utiliser l’hélianthine pour détecter l’équivalence de ce
titrage acido-basique ? Expliquer.
Non, la zone de virage de
l'hélianthine ne contient pas le pH de l'équivalence.
|
|