QCM
de chimie.
Concours kiné Berck 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Titrage
de l'acide benzoïque par la soude.
A 20°C, on dissout une masse m = 0,50 g d'acide benzoïque solide de
formule C6H5COOH
dans un becher contenant environ 100 mL d'eau distillée. Après quelques
minutes d'agitation on constate que tout l'acide benzoïque ne s'est pas
dissous. On filtre la solution contenue dans le becher et le filtrat
obtenu constitue une solution saturée S d'acide benzoïque. On
prélève à la pipette jaugée un volume VS = 10,0
mL de la
solution S que l'on verse dans un erlenmeyer. On y ajoute quelques
gouttes de rouge de crésol et l'acide benzoïque est titré par une
solution aqueuse d'hydroxyde de sodium de concentration molaire en
soluté apporté cB = 2,00 10-2
mol/L.
Il y a changement de couleur pour un volume d'hydroxyde de sodium versé
de VE=11,9 mL.
La
solubilité s d'une espèce chimique dans l'eau est la masse maximale de
cette espèce que l'on peut dissoudre dans un litre d'eau, à une
température donnée.
Calculer
la solubilité ( en g/L) de l'acide benzoïque dans l'eau à 20°C.
(1,7 ; 2,0 ; 2,3 ; 2,6 ; 2,9 ; aucune réponse exacte ).
A
l'équivalence VEcB =
[acide benzoïque] VS
;
[acide benzoïque] = VEcB
/ VS=11,9
*2,00 10-2
/10,0 =0,0238 mol/L.
Masse molaire de l'acide benzoïque M = 7*12+6+32=122 g/mol.
0,0238*122 = 2,9
g/L.
GPL.
Le
gaz de pétrole liquéfié ( GPL) est un mélange de propane et de butane
liquides. On considèrera un GPL composé d'un mélange, en volume, de 40
% de propane et de 60 % de butane. Une voiture consomme en moyenne 9,7
L de GPL aux 100 km.
La combustion du propane et du butane dans le moteur seront considérées
comme complètes.
Masse volumique du propane liquide rp
=515 kg m-3 ; du
butane liquide rb
=585 kg m-3.
Calculer
la masse de dioxyde de carbone ( en kg) rejetée dans l'atmosphère, par
la voiture, par km parcouru. (0,10 ; 0,12 ; 0,14 ; 0,16 ;
0,18 ; aucune réponse exacte ).
Masse
de propane : 9,7 10-3 *0,40 * 515 = 1,998 kg.
Quantité de matière de propane ( M = 3*12+8=44 g/mol) : np
=1998/44 =45,41 mol.
C3H8 +5O2
--> 3CO2 +4H2O.
Quantité de matière de dioxyde de carbone : 3 np
=136,24 mol.
Masse de butpane : 9,7 10-3 *0,60 * 585 = 3,405
kg.
Quantité
de matière de butane ( M = 4*12+10=58 g/mol) : nb
=3405/58 =58,70 mol.
C4H10 +6,5O2
--> 4CO2 +5H2O.
Quantité de matière de dioxyde de carbone : 4 nb
=234,8 mol.
Total : 371 mol de CO2 soit 371*44 =1,63 104
g pour 100 km.
163 g ou environ 0,16
kg de CO2 par km parcouru.
|
|
|
Réaction
entre les ions iodure et l'eau oxygénée.
L'eau oxygénée est une solution de peroxyde d'hydrogène H2O2.
La réaction entre le peroxyde d'hydrogène et les ions iodure I-
est une réaction lente mais totale qui conduit à la formation de diiode
I2 et d'eau.
A la date t=0, on verse dans un becher V1 =20,0
mL d'une solution aqueuse d'iodure de potassium ( K+aq
+I-aq) acidifiée par de l'acide sulfurique, de
concentration molaire en soluté apporté c1 =0,10
mol/L, V2 = 2,0 mL d'eau oxygénée de
concentration molaire en soluté apporté c2 =0,12
mol/L et V3 = 8 mL d'eau distillée.
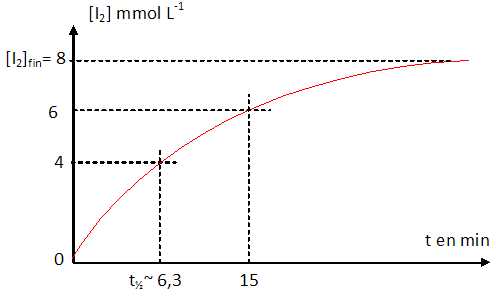
L'étude spectrophotométrique de la réaction a permis d'obtenir la
courbe ci-dessous.
Couples oxydant / réducteur mis en jeu : H2O2
aq / H2O et I2aq / I-aq.
Parmi
les affirmations suivantes, combien y en a t-il d'exactes ?
A.
L'équation de la réaction s'écrit : H2O2
aq + 2I-aq
--> 2H2O
+I2aq. Faux.
Oxydation
des ions iodures 2I-aq
-->I2aq
+2e-.
Réduction de H2O2
aq : H2O2
aq + 2e-+2H+aq
= 2H2O.
Bilan : H2O2
aq +2I-aq+2H+aq
= 2H2O+I2aq.
B.
Le peroxyde d'hydrogène et les ions iodures ont été introduits dans des
proportions stoechiométriques. Faux.
n(I-aq) = c1V1 =0,10*20,0 = 2,0 mmol ;
n(H2O2
aq) =c2V2 =2*0,12 = 0,24 mmol.
0,24 mmol de peroxyde d'hydrogène réagit avec 0,48 mmol d'ion iodure ;
ces derniers sont en excès.
C. Le peroxyde
d'hydrogène est réduit par les ions iodures. Vrai.
D. Le temps de
demi-réaction t½ est la durée nécessaire pour
consommer la moitié de la quantité initiale des ions iodure. Faux.
Le temps de demi-réaction t½ est la durée nécessaire pour
consommer la moitié de la quantité initiale de réactif limitant, le
peroxyde d'hydrogène dans ce cas.
E. A la date t =
15 min, la concentration en diiode formé a atteint sa valeur maximale.
Faux.
A la fin de
la réaction, il se forme 0,24 mmol de diiode dans un volume égal à
30 mL.
[I2]=0,24/30 =8 10-3
mol/L =8 mmol /L.
Déterminer
le temps de demi-réaction t½ ( en min).
(4,4 ; 5,8 ; 6,3
; 7,2 ; 7,8 ; aucune réponse exacte ).
|
.
|
|
L'adrénaline.
L'adrénaline est un stimulant du système nerveux central dont la
formule topologique est donnée.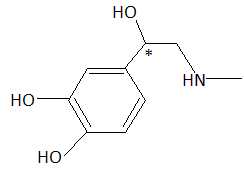
Parmi les
affirmations suivantes, combien y en a t-il d'exactes ?
A.
La masse molaire de l'adrénaline est M = 183 g/mol. Vrai.
M(C9H13O3) =12*9+13+3*16 +14=183 g/mol.
B. L'adrénaline
possède une fonction amide. Faux.
C. L'adrénaline
possède deux carbones asymétriques. Faux.
D. L'adrénaline
possède quatre stéréoisomères de configuration.
Faux.
Deux énantiomères.
E. La molécule
d'adrénaline est chirale. Vrai.
|
|
|