Solubilité de
l'acide benzoïque, étude de l'ibuprofène,
concours kiné Assas 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
.
.
|
|
|
|
|
|
|
|
Solubilité de
l'acide benzoïque.
A 20°C, l'acide benzoïque se présente à l'état pur sous forme de
cristaux blancs, C6H5COOH (s). La dissolution de
ce solide dans l'eau est modélisée par l'équation chimique suivante :
C6H5COOH
(s) = C6H5COOH(aq).
Une solution saturée d'acide benzoïque est obtenue lorsque des cristaux
solides restent présents dans la solution de cet acide. A 20°C, on peut
dissoudre au maximum 2,93 g d'acide benzoïque pur par litre de solution.
l'acide benzoïque appartient au couple acide / base : C6H5COOH(aq)
/ C6H5COO-(aq)
Ecrire l'équation
chimique modélisant la réaction entre l'acide benzoïque et l'eau.
C6H5COOH(aq)
+H2O(l)= C6H5COO-(aq)+H3O+(aq).
Déterminer
la concentration molaire volumique en acide apporté dans un litre de
solution saturée d'acide benzoïque à 20°C. En déduire la solubilité s
de cet acide.
M(acide benzoïque) = 7*12+6+32 =122 g/mol.
n = m / M = 2,93 / 122 =2,4016 10-2 ~2,40 10-2
mol dans un lite ; s = 2,40
10-2 mol/L.
On considère une solution S d'acide benzoïque de volume V = 20,0 mL
Quelle serait la
valeur de l'avancement maximal de la réaction entre l'acide benzoïque
et l'eau ?
Dans
l'hypothèse où la réaction entre l'acide benzoïque et l'eau est totale,
l'avancement maximale vaut :
xmax =s V = 2,40 10-2
*0,0200 = 4,80 10-4 mol.
Le pH de la solution est égal à 2,90.
Construire le
tableau d'évolution de la réaction entre l'acide benzoïque et l'eau.
|
Avancement
(mol)
|
C6H5COOH(aq)
|
+H2O(l)
|
= C6H5COO-(aq)
|
+H3O+(aq)
|
initial
|
0
|
sV
|
solvant
|
0
|
0
|
en
cours
|
x
|
sV-x
|
x
|
x
|
à
l'équilibre
|
xéq
= V 10-pH
|
sV-xéq |
xéq
|
xéq
|
Déterminer
l'avancement final puis le taux d'avancement final t de cette réaction.
xéq
=V 10-pH = 0,0200*10-2,90 = 2,52 10-5
mol.
t = xéq
/ xmax =2,52
10-5 /(4,80
10-4)=
5,25 10-2.
La
transformation étudiée est-elle totale ? Justifier.
t <1, la
transformation n'est pas totale.
On titre la solution S par de la soude à 7,50 10-2 mol/L en
soluté apporté.
Calculer
le volume de solution titrante versé pour obtenir l'équivalence.
Véq = V s / Csoude = 20,0 *2,40 10-2 /
(7,50 10-2)=6,40 mL.
Quelle
est l'espèce du couple acide base prédominante dans le milieu
réactionnel, pour les volumes V de solution de soude versés figurants
dans le tableau suivant ?
Volume
de solution titrante versé
|
Espèce
prédominante du couple acide / base
|
V
= 1,5 mL
|
C6H5COOH(aq)
: pH < pKa.
|
V
= 3,2 mL = ½Véq.
|
[C6H5COOH(aq)]
= [C6H5COO-(aq)] : pH = pKa. |
V
= 6,4 mL
|
C6H5COO-(aq) : pH > pKa. |
|
|
|
Etude de l'ibuprofène.
M = 206 g/mol.
Entourer le groupe caractéristique associé à la fonction acide carboxylique. Nommer ce groupe.
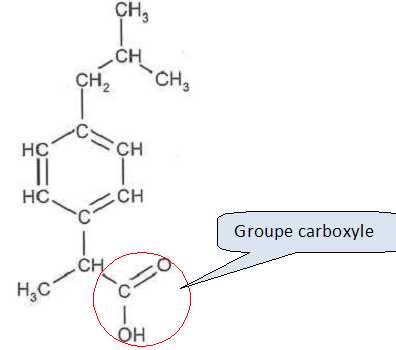
Cette molécule est-elle chirale ? Justifier.
Cette
molécule possède un atome de carbone asymétrique, c'est à dire un atome
de carbone tétragonal lié à 4 atomes ou groupes d'atomes différents.
Une molécule possédant un atome de carbone asymétrique est chirale.
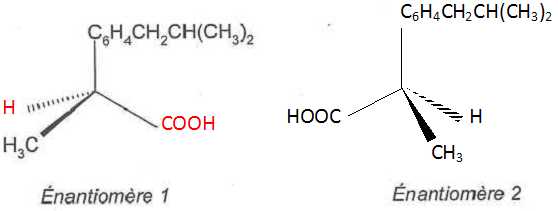
Comment appelle-t-on les configurations suivantes de l'ibuprofène ? Justifier.
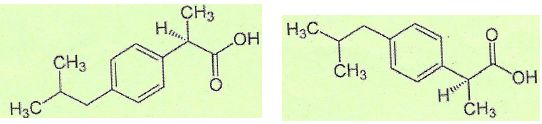
Une
molécule chirale n'est pas superposable à son image dans un miroir. La
molécule et son image dans un miroir constitue un couple d'énantiomères. Deux énantiomères sont 2 isomères de configuration, images l'un de l'autre dans un miroir.
|
.
On
souhaite déterminer la teneur d'un comprimé d'ibuprofène ( 400 mg
d'après le fabricant ). L'ibuprofène est très peu soluble dans l'eau
mais très soluble dans l'éthanol. On dissout un comprimé dans 200 mL
d'une solution hydro-alcoolique dont le comportement est assimilable à
celui d'une solution aqueuse. Après élimination des excipients (
insolubles dans l'eau et l'éthanol ), 50,0 mL de cette solution sont
dosés par une solution d'hydroxyde de sodium de concentration 0,0500
mol/L. Véq = 9,70 mL.
Quelle est la masse d'ibuprofène dans le comprimé testé ?
Quantité de matière d'ibuprofène dans 50 mL : 0,0500*9,70 10-3 = 4,85 10-4 mol ; soit dans 200 ml : 1,94 10-3 mol.
Masse : n M = 1,94 10-3 *206 =0,3996 g ~400 mg.
|
|