Métallurgie de
l'uranium
Concours ingénieur de l'industrie et des Mines 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Propriétés de l'uranium.
L'uranium est un élément qui possède plusieurs isotopes.
Définir
isotopes. Citer deux isotopes d'un autre élément. Dire pourquoi, d'un
point de vue purement chimique, il n'y a pas de différence de
comportement entre 2 isotopes .
Deux isotopes ne se différencient que par leur nombre de neutrons. Ils ont le même numéro atomique Z.
Exemple : 3517Cl et 3717Cl ; 126C et 146C.
La seule différence de comportement est liée à leur différence de masse : ils ont donc les mêmes propriétés chimiques.
Donner la composition de chacun des noyaux de l'uranium.
23592U : 92 protons et 235-92 =143 neutrons ; 23892U : 92 protons et 238-92 =146 neutrons.
La masse molaire de l'uranium naturelle est 238,0289 g/mol. Masse
molaire de l'uranium 235 : 235,0439 g/mol ; de l'uranium 238 : 238,0508
g/mol.
En déduire la teneur en uranium 235.
On note x la teneur en uranium 235 de l'uranium naturel :
235,0439 x +238,0508(1-x) = 238,0289 ; 3,0069 x =0,0219 ; x = 0,0073 (0,73 %). L'uranium naturel existe sous trois formes cristallines notées a, ß et g. La variété g est stable entre 775°C et 1130°C et cristallise sous forme cubique centrée.
Représenter cette maille. Combien la maille contient-elle d'atomes ?
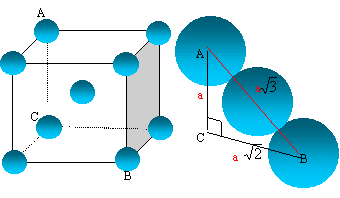
La tangence s'effectue suivant la grande diagonale du
cube :
a racine
carrée (3) = 4 R
Les 8 atomes situés aux sommets du cube sont
communs à 8 mailles et comptent pour 1/8=0,125.
celui du centre, commun à une seule maille, compte
pour une unité.
nombre d'atomes d'uranium appartenant à la maille
: 8* 0,125 +1 =
2.
Le paramètre de maille est 350 pm.
En déduire le rayon moyen de l'uranium dans cette structure supposée compacte.
R = 350*3½/4 =152 pm.
|
| .
. |
|
|
Elaboration du combustible.
Réduction de UO3 :
3UO3(s) + 2NH3(g) = 3UO2(s) +N2(g) +3H2O(g) (1).
Calculer DrH°(298K).
DrH° =3DfH°(UO2(s))+3DfH°(H2O(g))-2DfH°(NH3(g))-3DfH°(UO3(s)).
DrH° =3*(-1085)+3(-241,8)-2(-46,19)-3(-1224)= -216 kJ/mol.
Pour favoriser la formation de UO2(s), a-t-on intérêt à travailler à haute ou à basse température ? A-t-on intérêt à travailler à pression élevée ? Justifier.
DrH° est négatif : la réaction est exothermique et sera favorisée par un température peu élevée.
Initialement il y a 2 moles de gaz, finalement il y a 4 moles de gaz : la réaction est favorisée par une pression assez faible.
Calculer DrS°(298K) en se plaçant dans l'approximation d'Ellingham), qu'on rappellera, déterminer DrG°(298K).
L'enthalpie standard de réaction et l'entropie standard DrS° de la réaction ne dépendent pas de la température en dehors de tout changement de phase.
DrS° =3S°(UO2(s))+3S°(H2O(g))+S°(N2(g))-2S°(NH3(g))-3S°(UO3(s)).
DrS° =3*77,8 +3*188,7+191,5-2*192,3-3*98,6=310,6 J K-1 mol-1.
DrG° =DrH°-TDrS° =-2,16 105 -298*310,6 =-3,09 105 J/mol.
On travaille à 900 K sous 1 bar. Calculer la constante d'équilibre et conclure.
DrG° =-RT ln K ; ln K = DrG° /(-RT) =3,09 105 /(8,314*900) =41,3 ; K = 8,6 1017.
La constante K étant grande, la réaction est totale.
|
.
|
|
Fluoration de UO2.
UO2(s) +4HF(g) = UF4(s) +2H2O(g) (2).
DrG°(T) =-235,2 +0,2435 T en kJ/mol.
On maintient la température à 700 K et la pression à 1 bar.
Déterminer la constante d'équilibre K2 à 700 K.
DrG°(700) =-235,2+0,2435 *700 = -64,75 kJ/mol = -6,475 104 J/mol.
ln K2 = DrG° /(-RT) =6,475 104 /(8,314*700) =11,13 ; K2 = 6,79 104.
On part de 1 mole de UO2 et 1 mole de HF.
Quelle est la composition finale ?
|
avancement (mol)
|
UO2(s) |
+4HF(g) |
= UF4(s) |
+2H2O(g) |
initial
|
0
|
1
|
1
|
0
|
0
|
à l'équilibre
|
x
|
1-x
|
1-4x
|
x
|
2x
|
0,243
|
0,757
|
0,028
|
0,243
|
0,486
|
Nombre total de mol à l'équilibre : n =2-2x ; pression partielle de HF : p1=(1-4x) / ((2-2x) ; pression partielle de H2O : p2=2x/(2-2x) = x/(1-x).
K2 = p22 / p14 =16x2(1-x)2 / (1-4x)4 ; K2 (1-4x)4 =16x2(1-x)2 ; K2½ (1-4x)2 =4x(1-x) ; K2½ =260,6.
260,6(1+16x2-8x) =4x-4x2 ; 4,173 103 x2 -2,0886 103 x+260,6=0 ;
x2 -0,500 x +0,06245=0 ; D = 0,52 -4*0,06245 =2 10-4 ; x = ½(0,5-1,414 10-2) =0,243.
Même question en partant de 0,1 mole de UO2 et 1 mole de HF. Que remarque-t-on dans ce cas ?
|
avancement (mol)
|
UO2(s) |
+4HF(g) |
= UF4(s) |
+2H2O(g) |
initial
|
0
|
0,1
|
1
|
0
|
0
|
à l'équilibre
|
x
|
0,1-x
|
1-4x
|
x
|
2x
|
0,1
|
0
|
0,6
|
0,1
|
0,2
|
UO2(s)
est en défaut et la réaction est totale : à l'équilibre x = 0,1
mol. Le rendement par rapport au réactif en défaut est de 100 %.
|
Obtention de l'uranium métallique.
UF4(s) + 2Mg(s) =U(s) + 2MgF2(s) (3).
Calculer DrH°(298K).
DrH° =2DfH°(MgF2(s))-DfH°(UF4(s)).
DrH° =2*(-1124)-(-1921)= -327 kJ/mol.
DrH° est négatif, la réaction est exothermique.
Quelles conditions doivent être réunies pour obtenir les produits sous la température la plus élevée possible ?
La réaction (3) est favorisée par des températures peu élevées.
Les réactifs seront utilisés en proportions stoechiomètriques.
Pour un système adiabatique, l'énergie libérée par la réaction est entièrement gagnée par les produits.
A partir de la température initiale 298 K, calculer la température maximale atteinte. On fait l'hypothèse qu'il n'y a pas de changement d'état.
Les réactifs étant en proportions stoechiométriques et la réaction
étant totale, les réactifs disparaissent rapidement. le milieu
réactionnel ne contient que les produits.
|DrH°| =(Cp(U(s))+2Cp(MgF2(s))) ( Tf-Ti) ;
3,27 105 =(27,67 +2*61,5)(Tf-298) =150,67 Tf-4,49 104 ; Tf = 2468 K.
L'hypothèse formulée est inexacte, les température de fusion des produits étant bien inférieures à 2468 K.
La température réelle est moins grande mais l'uranium reste tout de même à l'état liquide. Expliquer en quoi c'est un avantage.
Le métal à l'état liquide peut être récupéré par coulée.
|
|