Utilisation du zinc pour déterminer la teneur en nitrates d'une eau.
Concours technicien supérieur de l'industrie et des Mines 2010
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Les ions nitrates provenant des engrais azotés et des oxydes d'azotes ( NO, NO2
) produits par les combustions s'accumulent dans les eaux des fleuves,
des rivières et des nappes phréatiques. La présence des nitrates dans
les eaux de surface est régulièrement contrôlée. Afin de déterminer la
quantité de matière en ion nitrate d'une eau, il faut d'abord réduire
les nitrates NO3- en ions nitrites NO2-
par le métal zinc en excès. Les ions nitrites sont ensuite oxydés
par une solution de permanganate de potassium, de concentration connue,
en milieu acide.
Ecrire la demi-équation d'oxydoréduction relative au couple NO3- / NO2-.
NO3- +2H++2e- = NO2- +H2O.
Ecrire celle relative au couple Zn2+ / Zn.
Zn = Zn2++2e- .
Quelle est la réaction d'oxydoréduction entre les ions nitrate et le zinc ?
NO3- +2H++ Zn = NO2- +H2O + Zn2+. (1)
On réalise le titrage des ions nitrites formés par une solution de permanganate de potassium de concentration c = 7,50 10-4 mol/L. Un volume V = 5,2 mL de solution titrante est nécessaire pour oxyder la totalité des ions nitrites.
Ecrire la demi-équation d'oxydoréduction relative au couple MnO4- / Mn2+.
MnO4- +8H+ +5e- = Mn2++ 4H2O.
En déduire l'équation de la réaction de titrage entre les ions nitrite et les ions permanganate.
5 fois { NO2- +H2O = NO3- +2H++2e- }.
2 fois {MnO4- +8H+ +5e- = Mn2++ 4H2O}.
Ajouter : 5NO2- +5H2O +2MnO4- +16H+ +10 e-= 5NO3- +10H++10e-+2 Mn2++ 4H2O.
Simplifier : 5NO2- +2MnO4- +6H+ = 5NO3- +2 Mn2++ 3H2O.
|
| .
. |
|
|
Compléter le schéma du titrage.
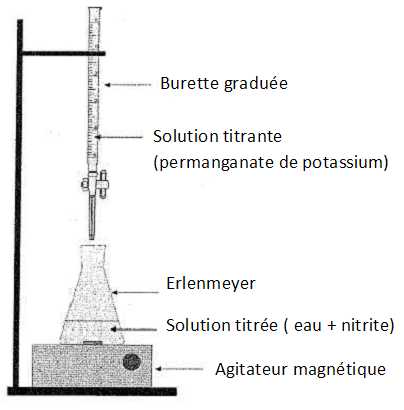
|
.
|
|
Déterminer
la quantité d'ion nitrite titrée.
A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques.
n(MnO4-) = cV = 7,5 10-4 *5,2 10-3 =3,9 10-6 mol.
D'après les nombres stoechiométriques de l'équation de titrage :
n(NO2-) = 2,5 n(MnO4-) =2,5 * 3,9 10-6 =9,75 10-6 mol.
D'après (1) n(NO3-) = n(NO2-) =9,75 10-6 mol.
Une eau est normale lorsque sa concentration en nitrate est inférieure à 50 mg/L.
Sachant que le volume prélevé au départ est égal à V0 = 25 mL,
déterminer la concentration massique en ion nitrate.
[NO3-] =n(NO3-) /V0 = 9,75 10-6 /0,025 = 3,9 10-4 mol/L.
M(NO3-) = 14 +3*16 = 62 g/mol.
[NO3-] M(NO3-) =3,9 10-4 *62 =2,42 10-2 g/L = 24,2 mg/L.
la composition de l'eau souterraine ne dépasse pas le seuil de tolérance en ions nitrates.
|
|