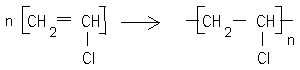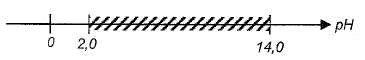Grillage de la blende ; hydrométallurgie de la calcine ; obtention du
zinc par électrolyse.
Concours technicien supérieur de l'industrie et des Mines 2010
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Le
zinc et la blende.
Le numéro atomique du zinc est Z = 30. L'élément zinc possède 5
isotopes naturels : 64Zn, 66Zn,
67Zn, 68Zn, 70Zn.
Définir le
terme isotope.
Deux isotopes ne diffèrent que par leur nombre de neutrons ; ils
possèdent le même numéro atomique Z.
Déterminer
les nombres de protons et de neutrons présents dans le noyau 68Zn.
30 protons et 68-30 = 38 neutrons.
Donner
la configuration de l'atome de zinc dans son état fondamental. Même
question pour l'ion Zn2+.
L'atome de zinc : 1s2 2s2
2p6 3s2 3p6
4s2 3d10.
L'ion Zn2+ : 1s2 2s2
2p6 3s2 3p6
3d10.
La
blende est un solide ionique. On peut décrire sa structure par un
réseau cubique à faces centrées constitué par les ions sulfures S2-,
les ions Zn2+ occupant la moitié des sites
tétraèdriques comme le montre la figure ci-dessous :
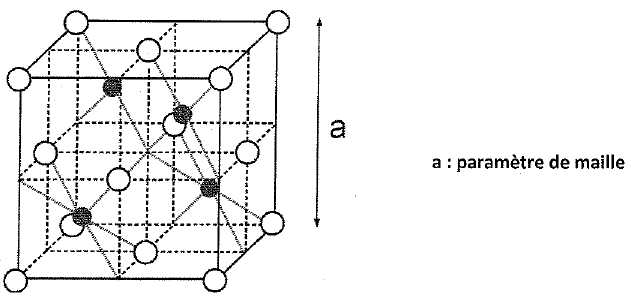
Les ions S2- sont figurés par les sphères
blanches ; les ions Zn2+ par les sphères noires.
Indiquer
le
nombre d'ions de chaque type par maille, vérifier alors la formule
brute de la blende ZnS et la neutralité électrique de la maille cubique
.
Les ions Zn2+ occupent 4 sites
tétraèdriques par maille.
Chaque
ion sulfure situé à un sommet du cube appartient à 8 mailles et compte
pour 1/8 ; il y a 8 sommets dans un cube : donc 1/8 *8 = 1.
Chaque
ion sulfure situé au centre d'une face du cube appartient à 2 mailles
et compte
pour ½ ; il y a 6 faces dans un cube : donc ½ *6 = 3. Donc au total 4
ions sulfure par maille.
Par
suite, la formule brute de la blende est ZnS et la maille reste
électriquement neutre. ( 4 cations avec deux charges positives et 4
anions possédant chacun 2 charges négatives).
|
| .
. |
|
|
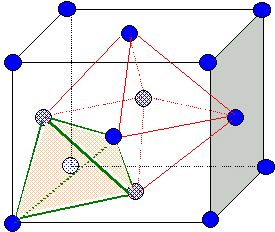
Indiquer
pour un ion zinc le nombre d'ions sulfures qui sont ses plus proches
voisins.
L'ion Zn2+ est au centre d'un tétraèdre dont les
4 sommets sont occupés par 4 ions S2-.
Site
tétraèdrique :
les sommets du
tétraèdre sont constitués par un sommet du cube et trois atomes au
centre de trois faces ayant ce sommet en commun. Il
y a huit
sites tétraèdriques.Seuls
4 sites tétraèdriques sont ocupés.
Répondre
à la même question pour un ion sulfure en considérant les 8 mailles qui
entourent l'ion étudié. En déduire la coordinence de la maille.
Chaque ion sulfure a 4 ion zinc comme plus proches voisins ; la
coordinence est égale à 4.
Etablir
la condition de tangence entre les ions Zn2+ et S2- en
fonction du paramètre de maille noté a et les rayons ioniques r(Zn2+) et r(S2-). En
déduire la valeur de a.
Dans les structures ioniques idéales, les ions sont assimilés à des
sphères dures.
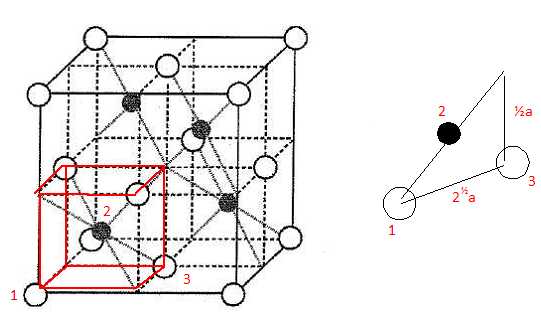
Dimension de la
grande diagonale du petit carré rouge ( figure ci-dessus) :
d2= (½a)2 + (½2½a)2 ; d = 3½ a/2 ; r(Zn2+) +r(S2-) =½d =3½ a/4.
On donne r(Zn2+)
=74 pm et r(S2-) =184 pm.
a = 4( r(Zn2+) +r(S2-)) / 3½ = 4(74 + 184) / 3½ =596 pm.
La masse volumique de la blende est r = 4084 kg m-3.
Exprimer
r en
fonction de a, des masses moalires M(Zn) et M(S) et la constante
d'Avogadro NA.
En
déduire la valeur réelle de a.
r
= 4(M(Zn) + M(S)) / (NA a3
) avec M(Zn) et M(S) en
kg mol-1et a en mètre.
a =(4(M(Zn) + M(S)) /
(NA
r)1/3
= (4(65,4 +32,1) 10-3) /(6,02 1023*4084))1/3
=5,41 10-10 = 541 pm.
Comparer
cette valeur à celle obtenue précédemment. La structure de la blende
est-elle une structure idéale ?
La différence entre ces deux valeurs est de l'ordre de 10 %. La
structure de la blende n'est donc pas idéale.
|
.
|
|
Grillage
de la blende.
Le principe du grillage consiste à transformer le sulfure de
zinc solide ZnS(s) ( constituant principal de la blende ) en oxyde de
zinc ZnO(s) ( constituant principal de la calcite ). Le grillage est
effectué en chauffant fortementle sulfure de zinc en présence de
dioxygène de l'air. l'équation de la relation associée à la
transformation s'écrit :
ZnS(s) + 1,5O2(g) = ZnO(s)
+ SO2(g).
Déterminer
la masse mZnS de sulfure de zinc qu'il faut
utiliser pour produire une masse mZnO
= 1,00 103 kg d'oxyde de zinc.
Quantité de matière de ZnO = quantité
de matière de ZnS = 1,00 106 / (65,4+16) =
1,2285 104 mol.
mZnS = 1,2285 104
(65,4 +32,1) =1,198 106 g ~1,20 103
kg.
Calculer
l'enthalpie standard DrH°
de la réaction à 298 K.
DfH°(ZnS(s))
=-202,92 kJ/mol ; DfH°(ZnO(s))
=-347,98 kJ/mol ; DfH°(O2(g))
=0 ; DfH°(SO2(g)
=-296,90 kJ/mol.
DrH°
=DfH°(SO2(g)
+DfH°(ZnO(s))-DfH°(O2(g))-DfH°(ZnS(s))
=-347,98 -296,90-(-202,92) =-441,96 kJ/mol.
Calculer
l'entropie standard DrS°
de la réaction à 298 K ; que déduire de son signe ?
S°(ZnS(s))
=57,74 J mol-1 K-1 ; S°(ZnO(s))
=43,51 J mol-1 K-1 ; S°(O2(g))
=205,03 J mol-1 K-1 ; S°(SO2(g)
=248,53 J mol-1 K-1.
DrS°
=S°(SO2(g)
+S°(ZnO(s))-1,5
S°(O2(g))-S°(ZnS(s))
=248,53 +43,51 -1,5*205,03 -57,74 = -73,25 J mol-1 K-1.
L'entropie est une mesure du désordre : dans
ce cas il y a une diminution flagrante du désordre, on passe de 1,5
molécules de gaz à une seule. L'entropie
finale est inférieure à l'entropie initiale.
Calculer l'enthalpie libre standard DrG°
de la réaction à 298 K ; que déduire de sa valeur ?
DrG°
=DrH°
-T DrS°
=-441,96 103-298*( -73,25) = -4,20 105
J /mol.
Constante de cette réaction : ln K = -DrG°
/(RT) = 4,20 105
/(8.31*298) =170 ; K = 4,8 1073.
K est très grand, la réaction est totale.
Cette
réaction est-elle favorisée à hautes ou à basses températures ?
Justifier.
DrH°
est négative : la réaction est exothermique, donc favorisée par les
basses températures.
Le dioxyde de soufre, gaz toxique, ne doit pas être rejeté dans
l'atmosphère. Néanmoins, il constitue la matière première d'une
industrie.
Quel
produit, fabriqué à fort tonnage, est issu du dioxyde de soufre
?
L'acide sulfurique.
|
Obtention
du zinc par hydrométallurgie de la calcine.
L'obtention du zinc par hydrométallurgie se déroule en plusieurs étapes
:
Lixiviation
et élimination des ions fer (III).
La calcine est attaquée par une solution d'acide sulfurique. La
solution obtenue contient des ions Zn2+, mais
également un grand nombre d'impuretés. Parmi celles-ci figure l'ion Fe3+
qu'on élimine par précipitation avec les ions hydroxyde HO-.
L'équation de la réaction est : Fe3+aq + 3HO-aq
= Fe(HO)3 ( s).
Une
décantation permet de séparer la solution des résidus insolubles tel
que l'hydroxyde de fer (III). Ce dernier commence à prcipiter dès que
le pH est supérieur à 2,0. Le domaine d'existence de l'espèce Fe(OH)3
( s) en fonction du pH est hachuré sur le diagramme ci-dessous :
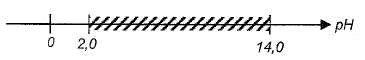
En présence d'ion hydroxyde, les ions zinc peuvent également précipiter
selon l'équation : Zn2+aq
+ 2HO-aq = Zn(HO)2 ( s).
La valeur de laconstante d'équilibre associée à cette équation est K =
1,0 1017 à 25°C.
Donner
l'expression littérale de K.
K = 1/([HO-aq]2[Zn2+aq]).
Calculer [HO-aq] si [Zn2+aq] =2,3 mol/L lorsque
l'hydroxyde de zinc commence à précipiter.
[HO-aq] = 1/(K[Zn2+aq])½
=1/(1,0 1017 *2,3)½ =2,1 10-9
mol/L.
En
déduire la valeur de pH pour laquelle l'hydroxyde de zinc (II) commence
à précipiter à 25 °C.
[H3O+aq]
= 10-14 / (2,1 10-9) = 4,8 10-6
mol/L ; pH = - log(4,8 10-6) =5,3.
Dans quel
intervalle de pH se place-t-on industriellement pour faire seulement
précipiter
l'hydroxyde
de fer (III) ? Justifier.
Entre pH=2 et pH = 5,2, l'hydroxyde de fer (III) précipite ; par contre
dans cet intervalle l'hydroxyde de zinc ne précipite pas.
Cémentation.
La cémentation est une opération de purification qui vise à débarasser
la solution contenant les ions Zn2+, destinée à
l'électrolyse, de cations métalliques tels que Cu2+.
Ces derniers sont réduits à l'aide d'une poudre de zinc métallique. Le
métal cuivre ainsi obtenu se dépose sur le zinc.
Ecrire
l'équation associée à la transformation entre les ions Cu2+aq
et le métal zinc On précisera les couples mis en jeu.
Cu2+aq / Cu(s) ; réduction de l'ion cuivre (II)
: Cu2+aq
+2e- = Cu(s).
Zn2+aq
/ Zn(s) : oxydation du zinc : Zn(s) = Zn2+aq
+2e-.
Bilan : Cu2+aq
+ Zn(s)
= Cu(s) + Zn2+aq.
Nommer une
technique de laboratoire simple permettant de séparer la solution
destinée à l'électrolyse des impuretés solides.
La filtration.
Electrolyse.
L'électrolyse est réalisée dans de grandes cuves. Le zinc métallique
obtenu est très pur. L'intensité du courant électrique dans le circuit
atteint 1,0 105 A. La solution électrolytique
est recyclée lorsque sa teneur en ion Zn2+aq
a atteint le tiers de sa valeur initiale. Les électrodes en allige de
plomb sont le siège d'une réaction dont l'équation est :
2H2O(l) = 4H+aq + O2(g)
+4e-.
les électrodes en alluminium sont le siège d'une réaction dont
l'équation est : Zn2+aq
+2e-= Zn(s).
Le
zinc métallique se dépose-t-il à l'anode ou à la cathode ? Justifier.
La réduction des ions Zn2+aq
nécessite un apport d'électrons de la part du générateur : elle
s'effectue à la cathode négative. |
|
|
On
considère une solution de concentration molaire effective initiale en
ion Zn2+aq égale à [Zn2+aq]1=2,3 mol/L et de volume V = 1,0 103 L.
Déterminer la durée de l'électrolyse Dt nécessaire pour atteindre une concentration molaire effective en ion zinc telle que [Zn2+aq]f =0,76 mol/L.
Quantité de matière d'ion zinc réduite en métal zinc : n = ([Zn2+aq]1-[Zn2+aq]f) V = (2,3-0,76) *1,0 103 = 1,54 103 mol.
Quantité de matière d'électrons : 2n = 3,08 103 mol.
IDt = 2n F avec F = 96500 C mol-1.
Dt = 2n F / I = 3,08 103 *96500 / (1,0 105) =2972 s ou 49,53 min ~ 46 min.
L'électrolyse
est réalisée dans des cuves en ciment revêtues de PVC vers 40°C. La
fabrication du PVC se fait en deux étapes : tout d'abord la production
du monomère, le chlorure de vinyle, puis sa polymérisation. Le monomère
est obtenu par addition de dichlore sur l'éthène puis élimination d'une
molécule de chlorure d'hydrogène HCl.
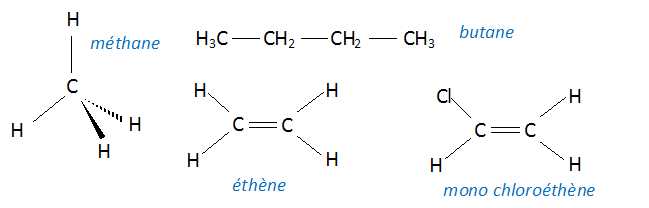
Donner la représentation de Cram du méthane et les formules semi-développées du butane, de l'éthène et du monochloroéthène.
Expliquer en quelques lignes en quoi consiste la distillation fractionée du pétrole.
La distillation fractionnée permet de séparer les
constituants d'un mélange liquide- liquide miscibles, possédant des températures
d'ébullition différentes.
Le constituant le plus volatil distille en premier ; la
séparation est d'autant plus facile que les températures d'ébullition sont
différentes.
Placer sur un schéma, les principales coupes pétrolières suivantes : bitume, butane, essence, fioul, gasoil, kérosène, méthane.
De bas en haut de la colonne on obtient : les bitumes, le fioul lourd, le kérosène, le gazoil, l'essence, le butane, le méthane.
Ecrire
l'équation de la réaction d'addition du dichlore sur l'éthène puis
celle de l'élimination du chlorure d'hydrogène permettant d'obtenir le
monochloroéthène.
C2H4 + Cl2 = CH2Cl--CH2Cl suivi de CH2Cl--CH2Cl = HCl + CH2=CHCl.
Ecrire l'équation de la réaction de polymérisation du chlorure de vinyle.
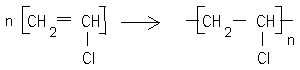
|