Le chrome sous ses différentes formes, concours inspecteur
CCRF 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Cet élément chimique a été découvert en 1797 par Vauquelin sous forme
de chromate de plomb PbCrO4. Il le nomme alors "chrome", signifiant en grec "couleur". Le
chrome est en effet l'élément qui fournit le plus grand nombre de couleurs dans ses composés.
Le degré d'oxydation zéro
Donner la représentation atomique de l'atome de chrome
(indiquant le nombre de masse et le numéro atomique).
5224Cr
Comment définit t-on deux atomes isotopes? Citer un exemple en
donnant les représentations atomiques.
Deux isotopes ne diffèrent que par leur nombre de neutrons ; ils ont le même numéro atomique. 23592U, 23892U.
Donner, en utilisant la règle de Klechkowski, la configuration
atomique de l'atome de chrome à l'état fondamental.
1s2 2s2 2p6 3s2 3p6 4s2 3d4.
Dans quelle colonne et dans quelle période de la
classification périodique se trouve l'élément chrome ?
4è période et 6è colonne.
Le chrome fait exception à la règle de remplissage de
Klechkowski (effet de spin maximal). Donner la configuration électronique réelle de l'atome de
chrome.
1s2 2s2 2p6 3s2 3p6 4s1 3d5. Le chrome est t-il un élément de transition ? Justifier.
Le chrome est un élément de transition : la couche 3d est partiellement ocupée.
Le degré d'oxydation III : l'hydroxyde amphotère Cr(OH)3.
Le précipité d'hydroxyde de chrome III (Cr(OH)3) se dissout en milieu basique et forme le complexe [Cr(OH)4]-.
Indiquer, en utilisant la règle de Klechkowski, la configuration atomique de l'ion Cr3+.
1s2 2s2 2p6 3s2 3p6 4s2 3d1.
Quelles sont les équations des réactions modélisant la formation de l'hydroxyde et du complexe à partir des cations Cr3+ et des ions hydroxydes HO- Calculer à 298K la valeur des constantes d'équilibres associées : K1 (hydroxyde) et K2 (complexe).
(1) Cr3+aq + 3HO-aq = Cr(OH)3 (s). K1 = 1/Ks =1/10-31 = 1031.
(2) Cr3+aq + 4HO-aq = [Cr(OH)4]- aq. K2 = ß = 1029,9.
Quelle
est l'équation de la réaction modélisant la formation du complexe à
partir de l'hydroxyde. Donner l'expression de la constante d'équilibre
de cette réaction K3 en fonction de K1 et K2, puis calculer la valeur de K3.
(2) -(1) donne : Cr(OH)3 (s) + HO-aq = [Cr(OH)4]- aq.
K3 = [[Cr(OH)4]- aq] /[HO-aq] =K2 / K1 = 1029,9/ 1031= 10-1,1 =7,94 10-2.
|
| .
. |
|
|
Quel est le nom du complexe formé ?
anion tétrahydroxochromate(III).
Comment peut-on justifier l'appellation "hydroxyde amphotère" pour Cr(OH)3?
En milieu acide, Cr(OH)3 (s) se comporte comme une base ; en milieu basique Cr(OH)3 (s) se comporte comme un acide.
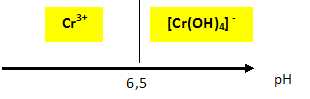
Le pH séparant les domaines de prédominance de Cr3+ et de [Cr(OH)4]- est de 6,5.
Justifier et détailler le calcul permettant d'arriver à cette valeur de pH. Représenter les deux domaines de
prédominance.
Cr3+aq + 4HO-aq = [Cr(OH)4]- aq. K2 = [[Cr(OH)4]- aq] / ([Cr3+aq] [HO-aq]4) = 1029,9.
Sur la droite frontière : [[Cr(OH)4]- aq] = [Cr3+aq] et K2 =1/[HO-aq]4 ;
[HO-aq] =(1/K2)0,25 =3,35 10-8 mol/L.
[H3O+aq) =10-14 / [HO-aq] = 10-14 /(3,35 10-8 ) =2,98 10-7 mol/L ; pH = -log(2,98 10-7 ) =6,5.
|
.
|
|
On considère désormais un litre de solution acidifiée de chlorure de chrome III à la concentration c = 1,0.10-3 mol. L-1.
On fait varier le pH de cette solution en ajoutant de la soude très
concentrée (la variation de volume est considérée comme négligeable).
Calculer le pH de début de précipitation de l'hydroxyde, noté pH1.
Pour cela, il sera fait l'hypothèse (puis vérifiée) que le milieu est suffisamment acide (pH << 6,5) pour que le cation Cr3+ soit ultra majoritaire par rapport à l'ion complexe.
Cr(OH)3 (s) = Cr3+aq + 3HO-aq ; Ks = 10-31 = [Cr3+aq][HO-aq]3.
[HO-aq]3 =Ks /[Cr3+aq] =10-31 /10-3 =10-28 ; [HO-aq] =4,64 10-10 mol/L
[H3O+aq) =10-14 / [HO-aq] = 10-14 /(4,64 10-10 ) =2,15 10-5 mol/L ; pH = -log(2,15 10-5 ) =4,67.
L'hypothèse est bien vérifiée.
Le degré d'oxydationVI.
Le trioxyde de chrome CrO3 est un oxyde très soluble dans l'eau. Il donne le diacide H2CrO4 ( pKa1 = 0,75 ; pKa2 = 6,45).
En solution, les ions chromate (jaune) peuvent former l'ion dichromate Cr2O7 2- (orange) selon la réaction suivante :
2 CrO42-aq +2H3O+aq = Cr2O7 2- aq +3H2O avec log (K4) = 14,5.
K4 =[Cr2O7 2- aq] /([CrO42-aq]2[H3O+aq]2)
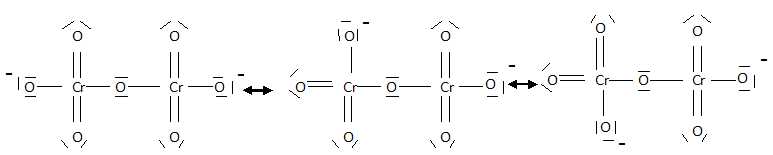
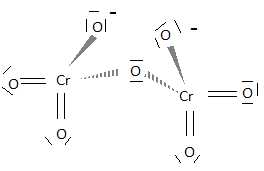
Donner une structure de Lewis de l'ion dichromate. Y a t-il d'autres formes mésomères de cette structure ? Justifier.
Il y a plusieurs formes mésomères, par exemple :
|
Quel est la nature du polyèdre de coordination? En déduire la représentation spatiale prévue par la théorie VSEPR (il n'y a que des liaisons Cr - O).
Chaque
atome de chrome est entouré de 4 atomes d'oxygène ( 4 directions de
liaisons) ; le chrome ne possède aucun doublet libre. Donc type AX4, structure tétraèdrique.
Quelle est l'équation de la réaction modélisant la formation de l'ion dichromate à partir de l'ion hydrogénochromate HCrO4- ?
2 HCrO4--aq = Cr2O7 2- aq +H2O
Donner l'expression de la constante de réaction K5 associée à cette réaction et calculer sa valeur numérique.
K5 = [Cr2O7 2- aq] /[HCrO4--aq]2.
De plus K4 =[Cr2O7 2- aq] /([CrO42-aq]2[H3O+aq]2)
et HCrO4--aq + H2O = CrO42-aq + H3O+aq ; Ka2 = [CrO42-aq][H3O+aq] / [HCrO4--aq].
K4 K2a2 =[Cr2O7 2- aq] / [HCrO4--aq]2 = K5.
K5 =1014,5 *(10-6,45)2 =101,6 =39,8.
S'agit-il d'une réaction d'oxydoréduction ? Justifier.
Le degré d'oxydation du chrome dans Cr2O7 2-est égal à +6 ; le degré d'oxydation du chrome dans HCrO4--est égal à +6 ; le degré d'oxydation du chrome dans CrO42-est égal à +6 ; il ne s'agit pas d'une réaction d'oxydoréduction, le nombre d'oxydation du chrome ne variant pas.
|
|
|