QCM
transformations d'un gaz parfait :
concours CPR 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Une mole
de dioxtgène supposé comme gaz parfait est chauffé sous pression
constante de 300 K à 400 K.
R = 8,32 J mol-1 K-1.
Répondre
Vrai ou Faux.
La quantité de chaleur reçue par le dioxygène est égale à 2 kJ. Faux.
Q = CpDq avec Cp-Cv
= R et Cv = 2,5 R soit Cp
=3,5 R.
Q = 3,5*8,32(400-300)
=2912 J ~2,9 kJ.
L'énergie interne du dioxygène de dépend que de la température. Vrai.
La variation d'énergie interne du dioxygène durant cette transformation
est égale à 2,08 kJ. Vrai.
DU =CvDq=2,5*8,32*100 =2080 J.
Le travail effectué au cours de la transformation est égal à 832 J.
Faux.
DU = Q + W ; W = DU - Q =2,08-2,9 = -0,82 kJ =-820 J.
Une masse de 1 g d'un gaz
supposé parfait se trouve dans les conditions initiales P1, V1
et T1 =300 K. On le comprime adiabatiquement jusqu'à ce que
son volume soit V2=V1/12, sa pression est alors P2
et sa température T2. On donne Cp =1 J g-1
K-1 et g = 1,4.
Sa température T2 est
: 510 K ; 610 K ; 710 K ; 810 K.
P1 V1g = P2V2g ; P1 = nRT1/V1
; P2 = nRT2/V2
;
nRT1V1g-1 = nRT2V2g-1 ; T2=
T1(V1/V2)g-1 =300*120,4=810
K.
Le travail mis en jeu lors de la
transformation adiabatique vaut ( en J)
: 436 ; 364 ; 643 ; 634.
dQ = 0 pour une adiabatique ; dU = dW+dQ = dW = nCv dT
; W = nCv(T2-T1).
Cp
/ Cv = g ; Cv = Cp / g ; n Cv
=1/1,4 J K -1.
W = 1/1,4 (810-300) =364
J.
|
| .
. |
|
|
La pression P2 est
maintenue constante et le gaz est refroidi jusqu'à la température T1. Son volume
est alors V3.
L'expression
de V3 en fonction de V1 est :
V3 = 0,01 V1 ; V3 = 0,02 V1
; V3 =
0,03 V1 ; V3 = 0,04 V1.
P1 = nRT1/V1
; P2 = nRT1/V3
; P2
/ P1= V1
/ V3.
P1 V1g = P2V2g ; P2
/ P1=( V1
/V2 )g =121,4 =32,423.
V1
/ V3 = 32,432 ; V3 =V1
/32,432 =0,03
V1.
|
.
|
|
La quantité de chaleur mise en jeu lors de
ce refroidissement est ( en J) :
-210 ; -310 ; -410 ; -510.
A pression constante, Q2 =
nCp DT avec nCp= 1 J K -1.
Q2 =300-810 = -510
J.
Le gaz subit
une détente isotherme réversible le ramenant au volume V1.
Le travail
mis en jeu au cours de cette transformation est (en J ) : 210 ;
-276 ; 285 ; -298.
Travail élémentaire des
forces de pression -pdV= -nRT /V dV = -nRT d(lnV).
Intégrer entre Vinitial et Vfinal
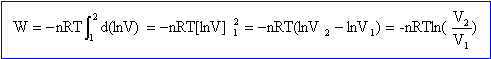
T =300 K ; rapport des volumes V1/V3 =32,432 ; nCp-nCv = nR ; nR = 1-1/1,4 =0,286 J K-1.
W = -0,286 *300 ln 32,432 =-298 J.
|
|
|