HPLC,
spectrographe de masse, colorimétrie : concours assistant d'ingénieur
2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
HPLC.
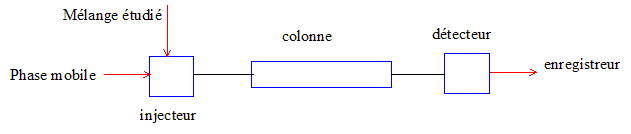
Un appareil de chromatographie liquide haute performance est équipé
d’un détecteur UV.
Faire
une description schématique de l’appareil.
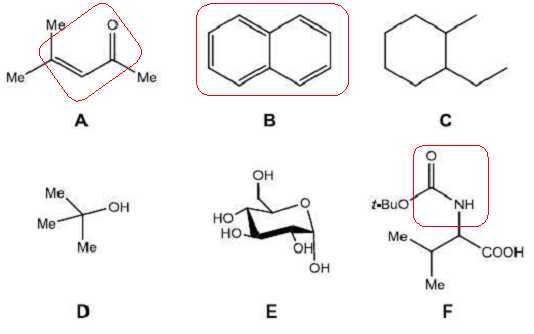
 Parmi les
6 molécules suivantes, lesquelles pouvez-vous détecter en sortie de
colonne ? Entourez-les et justifiez votre choix.
Parmi les
6 molécules suivantes, lesquelles pouvez-vous détecter en sortie de
colonne ? Entourez-les et justifiez votre choix.
Un détecteur UV décelera les molécules possèdant des systèmes conjugués
( liaisons multiples et doublets non liant ).
Citez
2 autres types de détecteur utilisés en HPLC.
Réfractomètre ;
spectromètre de masse ; conductimètre.
Définissez
les termes « mode isocratique » et « mode gradient » en chromatographie
liquide. Mode isocratique : la composition de la phase mobile ne change pas tout au long de l'analyse.
Mode gradient : la composition de la phase mobile est modifiée au cours de l'analyse.
On dispose au labo de 3 solvants de qualité HPLC : Eau, hexane et
méthanol.
Classer
ces solvants par pouvoir d’élution décroissant (du plus éluant au moins
éluant) sur une colonne polaire.
La colonne étant polaire, la phase mobile doit être la moins polaire
possible : hexane, méthanol, eau.
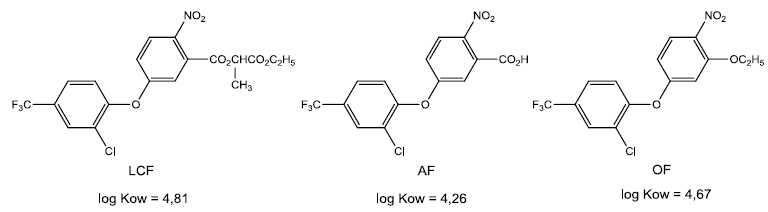
Le
lactofen (LCF), l’acifluorfen (AF) et l’oxyfluorfen (OF) sont des
herbicides de type diphényl-éther. On donne, à 25°C, les coefficients
de partage entre l’octanol et l’eau de ces composés.
|
| .
. |
|
|
Ces trois herbicides
peuvent être séparés par chromatographie de partage à polarités de
phases inversées. On utilise pour cela une colonne de silice greffée
C18 avec un mélange éluant eau/méthanol (9/1).
Quelles
sont les polarités des phases mobile et stationnaire.
La phase fixe est apolaire et la phase mobile est polaire.
Que
signifie C18 ?
Les
groupes alkyles greffés sur la phase stationnaire comptent 18 atomes de
carbone.
Quel sera
a priori l’ordre d’élution de ces trois composés (les classer selon
leur temps de rétention tR). Justifiez votre
réponse.
Au plus petit coefficient de partage correspond la molécule la plus
polaire. Ordre d'élution : AF, OF, LCF.
Dans
quel sens évolueront les temps de rétention dans la chromatographie
ci-dessus si on augmente la proportion de méthanol dans l’éluant ?
Justifiez votre réponse. Les classer par temps de rétention croissant.
L'éluant sera moins polaire. L'espèce la plus polaire ( AF)
éluera moins vite. L'espèce la moins polaire éluera plus vite que
précédemment.
|
.
|
|
Spectrographe
de masse :
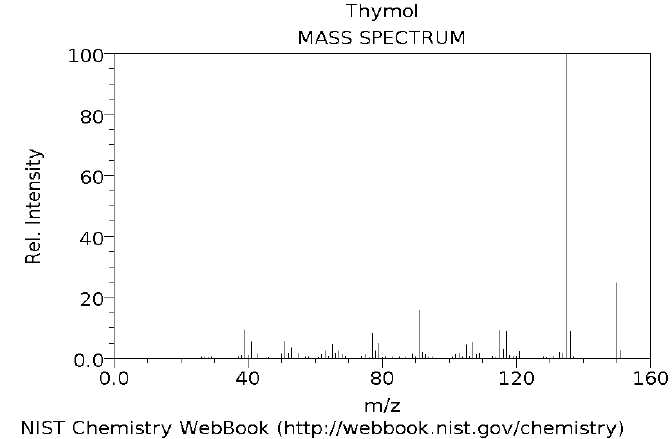
Que
signifie le rapport m/z sur le spectre du thymol ?
Il s'agit du rapport masse sur charge.
Indiquer
sur le spectre le pic moléculaire et le pic le plus abondant.
Le pic moléculaire est à m/z = 150 et le pic le plus abondant à m/z =
135.
Citer
2 types d’ionisation.
Ionisation électronique ; ionisation chimique ; l'électrospray.
Citer 2
types d’analyseur.
- analyseur quadripolaire ; - à temps de vol ; - à résonance cyclotronique
d'ions ; - à spectre magnétique.
.
|
|
Dosage
colorimétrique.
Le réactif R donne des complexes de couleurs différentes avec les ions
Cu2+, Zn2+ et Fe2+.
Il est donc possible d’utiliser la colorimétrie pour doser un mélange
contenant ces trois ions. On réalise pour cela des solutions étalons A,
B et C contenant chacune un seul ion complexé à une concentration
connue, puis on travaille sur une solution M qui contient les trois
ions à analyser, complexés avec ce même réactif R.
On obtient le tableau ci-dessous qui donne les pourcentages de
transmission des différentes solutions aux longueurs d’ondes choisies
par l’utilisateur pour ce dosage.
| Solution | Nature de l'ion | concentration molaire
du complexe ( mol/L) | Absorbance | | 380 nm | 612 nm | 750 nm | A
B
C | Cu2+
Zn2+
Fe2+
| 0,005
0,005
0,005 | 1,036
0
0 | 0
0,084
0,510 | 1,081
0,298
0 | | M | Cu2+
Zn2+
Fe2+ | x
y
z | 0,996 | 1,060 | 1,292 |
Déterminer
les concentrations molaires x, y et z des trois ions métalliques du
mélange M sachant que l’épaisseur de la cuve de mesure est de 10 mm.
Seul l'ion Cu2+ absorbe à 380 nm ; l'absorbance et la concentration étant proportionnelles :
x =0,005 *0,996 /1,036 =0,0048 mol/L.
A 750 nm l'ion Cu2+ et l'ion Zn2+ complexés absorbent : 1,081 = eCu2+ l c ; eCu2+=1,081 /(0,01*0,005) =2,162 104.
0,298 = eZn2+ l c ; eZn2+=0,298 /(0,01*0,005) =5,96 103.
1,292 = eCu2+ l x +eZn2+ l y ; 1,292 =2,162 104*0,010 x +5,96 103*0,010y ; 1,292 = 216,2 x +59,6 y.
y = (1,292-216,2*0,0048) /59,6 =4,27 10-3 mol/L.
A 612 nm l'ion Zn2+ et l'ion Fe2+ complexés absorbent : 0,084 = eZn2+ l c ; eZn2+=0,084 /(0,01*0,005) =1,68 10-3.
0,510 = eFe2+ l c ; eFe2+=0,510 /(0,01*0,005) =1,02 104.
1,060 = eZn2+ l y +eFe2+ l z ; 1,060 =1,68 103*0,010 y +1,02 104*0,010 z ; 1,060 = 16,8 y +102 z.
z = (1,060 -16,8 *4,27 10-3) / 102 =9,69 10-3 mol/L.
|
Hygiène et sécurité.
Définir ce qu’est un EPI. Citer 3 EPI indispensables dans un laboratoire de chimie.
EPI : équipement individuel de sécurité : blouse, gants, lunettes de protection.
Sur un flacon de formaldéhyde, on retrouve les pictogrammes suivants, indiquer la nature des risques associés : 
Toxique, cancèrigène, provoque des brûlures.
Quel type d’extincteur vous utiliseriez pour éteindre un feu de sodium ?
Poudre spéciale, sable.
Dans quoi est stocké l’acide fluorhydrique ? Quel gel applique t’on en cas de brûlure ?
Dans des récipients en plastique, dans un endroit bien ventilé, à moins de 15 °C, à l'abri de la lumière.
On applique un gel de gluconate de calcium à 2,5 %.
Quelles précautions doit-on prendre lorsque l’on utilise de l’azote liquide ?
L'azote liquide peut provoquer des gelures sévères : porter un équipement approprié protégeant les yeux et la peau.
Que doit porter le manipulateur d’un appareil de diffraction X ?
Protection en plomb.
Quelles
précautions doit prendre le manipulateur d’un appareil de RMN ? Quel
type de personne ne peut pas travailler près d’un appareil de RMN ?
La RMN utilise des champs magnétiques importants.
|
|