Propriétés
acido-basiques et redox d'espèces
azotées : concours assistant d'ingénieur 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Préparation d'une solution tampon.
On veut préparer 200 mL d'une solution S de pH = 8,9 à partir de V1 (en mL) d'une solution d'ammoniac de concentration C1 = 0,100 mol.L-1 et de V2 (en mL) d'une solution de chlorure d'ammonium de concentration C2 = 0,150 mol.L-1. Donnée : NH4+/NH3 pKa =9,2
Déterminer V1 et V2.
pH = pKa + log ([NH3] /[NH4+]) ; 8,9 = 9,2 + log ( C1V1/(C2V2)) ; -0,3 = log( 0,1V1/(0,15V2 )).
-0,3 = log( 0,667V1/V2) ; 0,501 =0,667V1/V2 ; V1/V2 =0,752.
De plus V1 +V2 = 200 ; 0,752V2 +V2 = 200 ; V2 =114,2 mL ; V1 =85,8 mL.
Oxydation à ébullition avec de l'acide sulfurique concentré.
A 100 mL de cette solution on ajoute 10 mL d'une solution d'acide chlorhydrique à 0,1 mol.L-1. On négligera la dilution. Déterminer le pH du mélange obtenu.
H3O+ +NH3 ---> NH4+ +H2O.
Quantité de matière d'ion oxonium ajouté : 0,1 *0,010 = 10-3 mol.
10-3 mol d'ammoniac disparaît et il se forme 10-3 mol d'ion ammonium.
n(NH3) finale = V1C1-0,001 = 0,00758 mol.
n(NH4+) finale = V2C2+0,001 = 0,01813 mol.
pH =9,2 +log(0,00758 / 0,01813) =8,82.
Quelles sont les propriétés d’une solution tampon ?
Le
pH d'une solution tampon ne varie pas lors d'une dilution modérée ; le
pH d'une solution tampon varie peu lors de l'ajout modéré d'un acide
fort ou d'une base forte.
Propriétés des ions nitrite.
L’acide nitreux, HNO2, et l’ion nitrite, NO2-, forment un couple acido-basique de pKa = 3,3.
Ecrire l’équation bilan de la réaction d’équilibre acido-basique de l’acide nitreux sur l’eau.
HNO2 aq+ H2O =NO2- aq+H3O+aq.
Exprimer sa constante d’équilibre en fonction des concentrations des espèces mises en jeu.
Ka = [NO2-][H3O+] /[HNO2].
Donner le diagramme de prédominance de HNO2 et NO2- en fonction du pH.
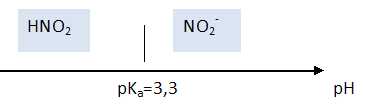
|
| .
. |
|
|
Ecrire la demi-équation de transfert électronique et la relation de Nernst correspondante pour le couple oxydo-réducteur NO3-(aq)/NO2(g).
NO3-aq +e- +2H+aq = NO2(g) +H2O.
E1 =E°(NO3-aq / NO2(g)) +0,006 log ( [NO3-aq][H+aq]2/PNO2 ).
Ecrire la demi-équation de transfert électronique et la relation de Nernst correspondante pour le couple oxydo-réducteur NO2(g)/NO2-(aq).
NO2(g) +e- =NO2- aq ; E2 =E°(NO2(g)/NO2- aq) +0,006 log (PNO2 /[NO2- aq] ).
|
.
|
|
En présence d’eau le dioxyde d’azote peut se dismuter en ions nitrates, NO3- et en nitrites NO2-. Ecrire l’équation bilan de cette réaction de dismutation.
2NO2 (g)+H2O =NO3-aq +NO2- aq +2H+aq.
Exprimer sa constante de réaction K en fonction de la pression partielle, PNO2 en bar, du dioxyde d’azote et des concentrations des espèces en solution aqueuse.
K =[NO3-aq][NO2- aq][H+aq]2/P2NO2.
Calculer, à partir des données, la valeur de K à 25 °C.
E°(NO3-aq / NO2(g))=0,83 V ; E°(NO2(g)/NO2- aq)=0,85 V à pH=0.
A l'équilibre : E1 =E2 ;
E°(NO3-aq / NO2(g)) +0,006 log ( [NO3-aq][H+aq]2/PNO2 )=E°(NO2(g)/NO2- aq) +0,006 log (PNO2 /[NO2- aq] )
0,006 log K =E°(NO2(g)/NO2- aq) -E°(NO3-aq / NO2(g)) =0,85-0,83 =0,02.
log K =0,02 /0,006 =3,33 ; K =2,15 103.
Cette réaction est à l’origine de la formation des pluies acides.
Une
atmosphère de pression totale 1 bar, chargée en dioxyde d’azote, se
trouve en équilibre avec une eau de pH = 4, l’acidité provenant de la
réaction de dismutation de NO2 dans l’eau. (on supposera que NO2(g) est insoluble dans l’eau). Déterminer la pression partielle PNO2 en bar, du dioxyde d’azote.
| avancement volumique (mol/L) | 2NO2 (g) | +H2O | =NO3-aq | +NO2- aq | +2H+aq | | initial | 0 | n |
| 0 | 0 | 0 | | équilibre | x | n-2x |
| x | x | 2x |
2x = 10-4 ; x = 5 10-5 mol. K = x2(2x)2 /P2NO2 = 2,15 103.
x(2x) / PNO2 =46,4 ; PNO2 =5 10-5* 10-4 /46,4 ~1,1 10-10 bar.
|
|
|