Cristallographie.
En
dessous de 184°C, le chlorure d’ammonium solide cristallise avec une
structure de type CsCl, de paramètre de maille a = 387 pm. L’ion
ammonium est supposé sphérique.
Représenter
la maille élémentaire et la nommer. Identifier le motif. Quelle est la
coordinence de chaque ion ?
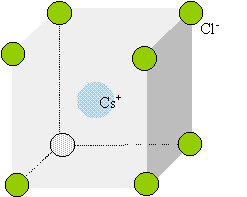
Structure cristalline cubique. Chaque ion NH4+
est équidistant de 8 ions chlorures. Chaque ion Cl- est
équidistant de huit ions NH4+. La coordinence est
égale à 8.
Calculer
la masse volumique de ce solide sachant que sa masse molaire est de
53,5 g.mol-1.
Volume de la maille élémentaire : V =a3 =(387 10-12)3
=5,796 10-29 m3.
Chaque maille élémentaire compte un ion ammonium et un ion chlorure; la
masse de la maille est égale à : 53,5 /(6,021023) =8,887 10-23
g = 8,887 10-26 kg.
Masse volumique : 8,887 10-26 /(5,796 10-29)
=1533 ~1,53 103 kg m-3.
Evaluer
le rayon ionique de l’ion ammonium supposé sphérique sachant que, dans
ce cristal, le rayon de l’ion chlorure est R = 187 pm.
Les ions sont tangents suivant la grande diagonale du cube.
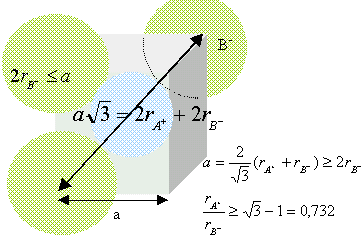
RNH4+ +RCl- = 387*1,732 / 2 =335 pm ; RNH4+
=335-187 =148 pm.
En
déduire la compacité du chlorure d’ammonium.
Volume des ions supposés sphériques : 4/3 p(R3NH4+ +R3Cl-
) =4*3,14 / 3(1873 +1483) (10-12)3
=4,097 10-29 m3.
Compacité = volume des ions / volume de la maille = 4,097 10-29
/ (5,796 10-29) ~0,71.
On réalise un diagramme de poudre sur ce solide. Pour quel angle q obtient-on un
maximum de signal correspondant à des plans atomiques séparés par le
paramètre de maille a sachant que l’on éclaire la poudre avec la
raie Ka du cuivre (l = 0,154 nm) ?
Lorsqu'un faisceau monochromatique arrive sur un cristal en faisant un
angle q avec une famille de
plans réticulaires, il est diffracté. Un maximum d'intensité se produit
lorsque les rayons diffractés sont en phase.
Loi de Bragg : 2 d sin q = n
l avec n entier,
ordre de diffraction et d : distance entre deux plans réticulaires
consécutifs de la même famille.
pour n = 1 et d = a : sin q
= l / (2a) =0,154 /
(2*0,387) =0,199 ; q =78,5°.
|