Pile,
concentration et absorbance, hydroxyde de sodium, aspirine,
chromatographie.
Concours technicien St Etienne 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Remplir le tableau
suivant :
Formule
brute
|
Formule
semi-développée
|
Nom
usuel
|
Fonction
caractéristique
|
C7H6O2
|
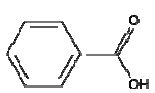
|
acide
benzoïque
|
acide
carboxylique
|
CH4O
|
CH3-OH
|
méthanol
|
alcool primaire
|
C3H6O2
|
CH3-COO-CH3
|
éthanoate
de méthyle
|
ester
|
| C3H6O |
CH3-CO-CH3
|
acétone
ou propanone
|
cétone
|
Ajuster les
équations de réactions suivantes.
Cr2O72- + 14H+
+6Fe2+ ---> 2Cr3+ +6Fe3+
+7H2O.
C4H10 +6,5O2
---> 4CO2 +5H2O.
I2 +2S2O32-
--->2 I- +S4O62-.
H2C2O4 + 2HO-
---> C2O42- +2H2O.
Pile.
On réalise la pile formée à partir des couples Ni2+/Ni et Zn2+/Zn.
M(Zn) = 65,4 g/mol ; M(Ni) = 58,7 g/mol ; e = 1,6 10-19 C ; NA
= 6,02 1023 mol-1 ; F = 96500 C.
Pour la réaction suivante Ni2++Zn = Zn2+ + Ni, la
constante vaut K = 1018.
L'électrode positive de cette pile est l'électrode de nickel. Chaque
solution a pour volume V = 100 mL et la concentration initiale en ion
positif est [Ni2+]=[Zn2+]=C = 5,0 10-2
mol/L.
Légender
le schéma.
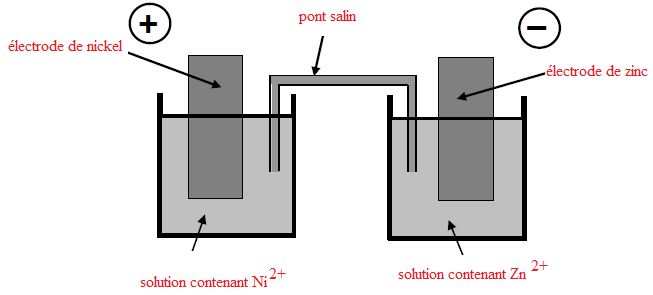
Ecrire
les demi-équations des réactions se produisant aux électrodes et
préciser s'il s'agit d'une oxydation ou d'une réduction.
Oxydation du zinc à l'anode négative : Zn (s) ---> Zn2+
aq +2e-.
Réduction des ions Ni2+ à la cathode positive : Ni2+
aq +2e----> Ni(s).
Ecrire l'équation de
la réaction globale qui intervient dans la pile.
Zn (s) +Ni2+
aq ---> Zn2+
aq +Ni(s).
On fait
débiter la pile dans un conducteur ohmique de valeur R.
Compléter
le schéma ci-dessus. Préciser sur ce schéma le sens du courant et le
sens de déplacement des électrons dans le circuit extérieur.
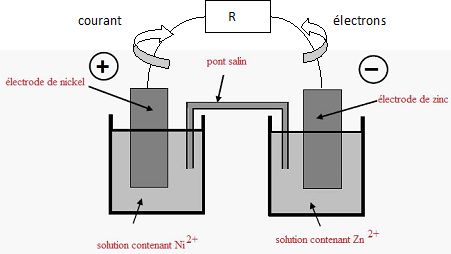
Comment varie la
concentration des ions positifs dans chaque becher ?
Les ions Ni2+ disparaissent: [Ni2+] diminue. Les ions Zn2+
apparaissent: [Zn2+] croît.
Sachant que la masse
des électrodes ne limite pas la réaction, pour quelle raison la pile
s'arrêtera-t-elle de fonctionner ?
Le quotient de réaction sera égale à la constante d'équilibre K ; les
ions Ni2+ auront pratiquement disparu.
On laisse fonctionner la
pile pendant une heure. L'intensité du courant reste constante et vaut
I = 100 mA .
Calculer
la quantité d'électricité fournie par cette pile.
Q = It = 0,100 *3600 = 360 C.
En déduire la
quantité de matière d'électrons qui ont circuler.
n(e -) = Q/F = 360 /96500 =3,73 10 -3 ~3,7 10 -3
mol.
Quelle électrode
voit sa masse augmenter ? Calculer cette
augmentation de masse.
La masse de l'électrode de nickel augmente.
n(Ni) = ½n(e-) =1,865 10-3 mol.
m = n(Ni) M(Ni) = 1,865 10-3
*58,7 =0,109 ~0,11 g.
|
| .
. |
|
|
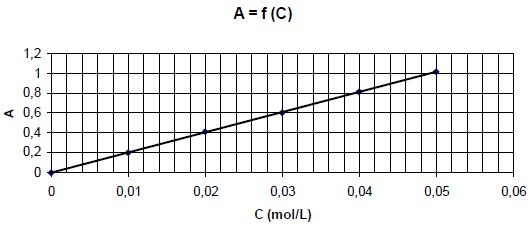
Concentration
et absorbance.
Pour des solutions de sulfate de nickel de concentrations différentes,
on trace la courbe donnant l'absorbance en fonction de la concentration
C en ion nickel Ni2+. Les mesures sont faites pour une
longueur d'onde égale à 390 nm.
Enoncer
la loi de Beer-Lambert et ses limites. Justifier le choix de la
longueur d’onde pour les
mesures.
Pour
des solution diluées, l'absorbance et la concentration de l'espèce qui
absorbe à la longueur d'onde choisie, sont propotionnelles. Afin
d'obtenir une bonne précision, on choisit la longueur d'onde
correspondant au maximum d'absorption.
Quel type d’appareil
utilise-t-on pour mesurer l’absorbance.
Un spectrophotomètre.
On
mesure l'absorbance de la solution, dans laquelle plonge l'électrode de
nickel, lorsque la pile a fonctionné une heure en débitant une
intensité de 100 mA. On rappelle que le volume de la solution est
V = 100 mL. La valeur mesurée est A = 0,65.
A
l’aide du graphe déterminer la concentration des ions Ni2+ restant en solution.
Equation de la droite : A = 20 c ; Crestante = 0,65 / 20 =
0,0325 mol/L.
Est-ce
cohérent avec le calcul de la masse de nickel déposé. Justifier votre
réponse.
Quantité
de matière en ion nickel :
initiale : CV = 0,050 *0,100 = 5,0 10-3 mol ;
au bout d'une heure : 0,0325 *0,100 = 3,25 10-3
mol ;
ayant disparu : 5,0 10-3 -3,25 10-3
=1,75 10-3 mol.
Masse de nichel déposé : 1,75 10-3 *58,7
~0,10 g. Les résultats sont cohérents.
|
.
|
|
Hydroxyde de
sodium.
Déterminer
la signification du pictogramme.
Ce produit est corrosif.
Donner
trois éléments de protection individuelle (EPI) nécessaires pour
manipuler ce produit.
Port de blouse, gants et lunettes de protection.
On dispose d’une solution d’hydroxyde de sodium à 40%. Calculer la
concentration en mol.L-1 de cette solution.
Justifier vos calculs.
Densité d = 1,43 ; masse molaire M = 40,0 g/mol.
Masse de 1 L de solution : 1,43 kg ou 1430 g.
Masse d'hydroxyde de sodium correspondante : 1430*0,40 = 572 g.
Quantité de matière correspondante : 572/40 = 14,3 mol dans 1 L.
A partir de la solution précédente, on veut préparer 1L de solution
d’hydroxyde de sodium de concentration 0,1 mol.L-1.
Calculer
le volume d’hydroxyde de sodium à 40% à prélever.
Facteur de dilution F = concentration mère / concentration solution
diluée = 14,3 / 0,1 = 143.
Volume de solution commerciale à prélever : 1000 / 143 ~7,0 mL.
Expliquer
le mode opératoire pour cette dilution, nommer la verrerie utilisée et
donner les précautions à prendre.
Port de blouse, gant et lunettes de protection pour prélever 7,0 mL de
la solution commerciale à l'aide d'une pipette graduée ou d'une burette
graduée.
Verser dans une fiole jaugée de 1,00 L remplie au quart d'eau
distilée. Compléter avec de l'eau distillée jusqu'au trait de jauge.
Boucher et agiter pour rendre homogène.
La solution d’hydroxyde de sodium (de concentration 0,1 mol.L-1)
préparée va servir à doser l’acide éthanoïque contenu dans du vinaigre.
Avant de réaliser ce titrage, une dilution au dixième
du vinaigre est effectuée. La solution diluée obtenue sera appelée S1.
Donner
le nom usuel de l’acide éthanoïque. Acide
acétique.
Titrage de l’acide éthanoïque du vinaigre. Le volume de solution S1
à titrer est V1 = 20 mL.
Faire
un schéma annoté du montage permettant de suivre l’évolution du pH en
fonction du volume v de solution d’hydroxyde de sodium versé.
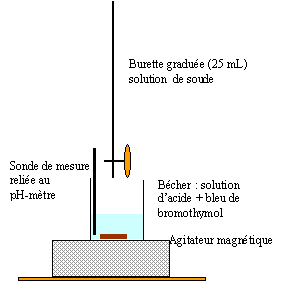
Ecrire
le couple acide/base correspondant à l’acide éthanoïque. Donner
également l’équation de la réaction chimique de ce titrage.
CH3COOH aq / CH3COO-aq.
CH3COOH aq +HO-aq ---> CH3COO-aq
+ H2O.
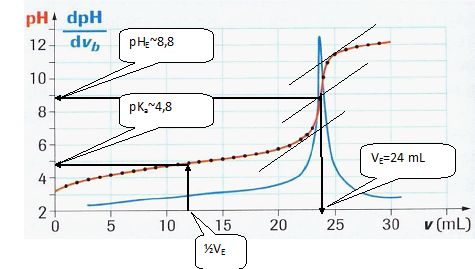
Les mesures réalisées, traitées par informatique, ont permis de tracer
les courbes représentées sur la figure ci-après.
Graphiquement,
déterminer le point d’équivalence E et ses coordonnées (vE et pHE) ainsi que le pKa de l’acide
éthanoïque (préciser la formule du Ka).
Ka = [CH3COO-aq][H3O+aq]
/ [CH3COOH aq].
Calculer
la concentration C1 de la solution.
A l'équivalence C1 V1 = CB VE
; C1 = CB VE / V1=
0,10 *24/20 =0,12 mol/L.
Calculer
la concentration C0 en acide éthanoïque
du vinaigre initial.
C0 = 10 C1 = 1,2 mol/L.
Le degré d’acidité du vinaigre est la masse, en grammes, d’acide
éthanoïque pur dans 100 g de vinaigre. Calculer le degré
d’acidité du vinaigre étudié.
M(CH3COOH) = 60 g/mol ; masse d'acide éthanoïque pur dans 1
L de vinaigre : 60*1,2 = 72 g/L ou 7,2 g dans 100 mL de vinaigre.
Masse volumique du vinaigre : 1,02 g/mL.
7,2 g d'acide éthanoïque dans 102 g de vinaigre soit : 7,2 *100/102 =
7,06 ~7,1 °.
Ce résultat est en accord avec l'indication de l'étiquette ( 7 ° ).
|
|
Synthèse de
l'aspirine.
Les élèves synthétisent l’acide acétylsalicylique (ou aspirine) par
réaction de m1 = 10,00 g d’acide salicylique avec V2
= 15,0 mL d’anhydride éthanoïque de masse volumique µ2 =
1,08 g.mL-1.
Ecrire
l’équation de la réaction. Donner ses caractéristiques.
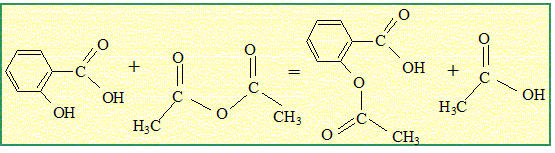
Cette réaction est
rapide et totale.
La synthèse est
réalisée en ajoutant quelques gouttes d’acide sulfurique au milieu
réactionnel. Quel
est son rôle ? Catalyseur.
Calculer
les quantités de matière initiales des réactifs (en mole).
V2 µ2 / M(anhydride éthanoïque) = 15,0
*1,08 / 102 =1,159 mol.
m1/(M(acide salicylique) = 10,00 / 138 = 7,25 10-2
mol.
Déterminer
la masse maximale mmax d’aspirine que les
élèves peuvent fabriquer.
Le réactif limitant est l'acide salicylique. On peut espérer obtenir au
mieux 7,25 10-2
mol d'aspirine.
mmax = 7,25 10-2 M(aspirine) = 7,25 10-2 *180 =13,0 g.
A la fin de la synthèse, les élèves purifient l’aspirine. Ils
obtiennent une masse, mexp = 9,80 g. Définir et calculer
le rendement de la synthèse.
masse expérimentale / masse théorique = 9,80 / 13,0 = 0,75 ( 75 % ).
Les élèves réalisent ensuite une chromatographie sur couche mince de
silice avec un éluant convenable. On obtient le chromatogramme suivant :
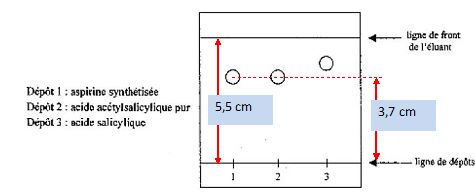
L’éluant contient du
cyclohexane. Donner
la signification des pictogrammes et les précautions à prendre lors de
l’utilisation de ce produit.
Inflammable, cancèrigène, toxique pour les organismes aquatiques et
l'environnement.
Travailler en évitant tout flamme, sous hotte aspirante en portant des
gants.
Définir
et calculer le rapport frontal de l’acide acétylsalicylique.
Distance parcourue par l'aspirine / distance parcourue par l'éluant =
3,7 / 5,5 = 0,67.
L’aspirine
synthétisée par les élèves est-elle pure ?
Le dépôt n°1 présente une seule tache, identifiable à l'acide
acéthylsalicylique. L'aspirine synthétisée est donc pure.
Citer
une autre technique pour vérifier la pureté éventuelle du produit obtenu.
Dans le cas d'un solide, mesure du point de fusion sur banc Kofler.
|
Traduire l’extrait suivant
de la notice du spectrophotomètre « SmartSpec Plus » :
``UV/Visible Spectroscopy is based on the absorption of light as a
function of wavelength.
All spectrophotometers have a light source that generates light of
specific wavelengths. The
SmartSpec Plus uses a xenon flash lamp as its light source. Xenon flash
lamps have several
advantages over the conventional light sources in that they reduce warm
up time, do not heat
up the instrument and have a lamp life of 10 to 15 years. Additionally,
xenon flash lamps emit
both UV and visible wavelengths, in contrast to deuterium lamps which
emit only UV
wavelengths or tungsten lamps which primarily emit visible wavelenghts.
In the SmartSpec
Plus, the xenon flash lamp pulses light only when measuring absorbance
of a sample.’’
La spectroscopie UV / visible est basée sur l'absorption de la lumière
en fonction de la longueur d'onde.
Tous les spectrophotomètres ont une source de lumière qui génère de la
lumière de longueurs d'onde spécifiques. Le
SmartSpec Plus utilise une lampe flash au xénon comme source de
lumière. Les lampes flash au xénon ont plusieurs avantages par rapport
aux sources de lumière conventionnelles car elles réduisent le temps
d'échauffement, ne chauffent pas l'instrument et ont une durée de vie
de 10 à 15 ans. En outre, les lampes flash au xénon émettent les
longueurs d'onde visibles et UV, contrairement aux lampes au deutérium
qui émettent uniquement dans l'UV
ou des lampes au tungstène qui émettent principalement des
longueurs d'onde visibles. Dans le SmartSpec De plus, les impulsions de
la lampe flash au xénon n'éclairent que lorsqu'on mesure l'absorbance
d'un échantillon. ''
|
|