Culture générale
en physique chimie.
Concours technicien 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Donner les unités SI
pour les grandeurs suivantes :
Température ( K) ; pression ( Pa) ; fréquence ( Hz) ; capacité( F) ;
courant électrique ( tension en volt et intensité en ampère ) ;
longueur d'onde (m).
Indiquer
si les matériaux suivants sont bons ou mauvais conducteurs électriques.
Bons conducteurs : laiton, mercure, platine.
Mauvais conducteurs : alumine, téflon, oxyde de zinc.
Convertions
d'unités.
1 nm = 10-9 m ; 1 ps = 10-12 s ; 1 µL = 10-6
L ; 1 mg = 10-3 g ; 1 MHz = 106 Hz ; 1 kJ = 103
J.
Citer
trois ports pour connecter un périphérique à un ordinateur.
Ports externes : USB, VGA, DVI ; ports internes : PCI, AGP.
Citer
au moins 4 éléments constitutifs d'une unité centrale.
Processeur, mémoire vive ( RAM), disque dur, carte mère, carte
graphique, bloc d'alimentation électrique.
Que
signifie : 1ko ( 1 kilooctet) ; 1 Mo.( un million d'octets).
Citer
deux systèmes d'exploitation.
Microsoft Windows, Mac OS X.
A quoi correspond
pour un écran, une vitesse de rafraichissement de 50 Hz ?
50 images s'affichent sur l'écran par seconde.
Comment branche-t-on
un ampèremètre, un voltmètre ?
Un ampèremètre est branché en série, un voltmètre en dérivation.
Quelle relation lie
la résistance électrique, la tension et l'intensité ? Donner les unités
et le nom de cette loi.
Loi d'ohm pour un conducteur ohmique U = RI. R en ohm, U en volt et I
en ampère.
On veut doser un comprimé d'aspirine. Pour cela on dispose d'une
solution de soude commerciale de densité 1,2 contenant en masse 20 % de
soude ( M= 40 g/L).
Quelle
est la concentration de cette solution ?
Masse de 1 L de solution : 1,2 kg = 1200 g.
Mase de soude : 0,20*1200 = 240 g. Concentration :240/40 = 6,0
mol/L.
On veut faire 100 mL de solution de soude à 0,06 mol/L pour le titrage.
Comment procède t-on
à partir de la solution commerciale ?
Facteur de dilution : F = 6 / 0,06 = 100.
Prélever 1,00 mL de solution commerciale à l'aide d'une pipette jaugée
; verser dans une fiole jaugée de 100 mL contenant un tires d'eau
distillée. Compléter avec de l'eau distillée jusqu'au trait de jauge.
Boucher et agiter.
On dose V=200 mL d'une solution d'aspirine par la soude préparée
ci-dessus. Véq = 10 mL de soude ajoutée.
Quelle est la
concentration de la solution d'aspirine.
C = Csoude Véq / V =0,06 *10 / 200 = 3 10-3
mol/L.
|
| .
. |
|
|
Le perchlorate de sodium Na+
+ClO4- est préparé à partir du chlorate de sodium
Na+ + ClO3- par électrolyse.
Comment
met-on en oeuvre une électrolyse ?
Plonger
deux électrodes dans une solution conductrice. Les électrodes sont
reliées à un générateur de courant continu.
Ecrire la
demi-équation électronique correspondant au passage de l'ion chlorate à
l'ion perchlorate.
ClO3-
+H2O =ClO4-
+2H++2e-.
A quelle électrode
se produit-elle ?
Une oxydation se produit à l'anode positive.
I = 4 A , rendement 50 %. n
= 1 mol de perchlorate, F = 105 C mol-1.
Quelle
est la durée de l'électrolyse ?
t = n(e-)
F / I avec n(e-) = 2 mol ; t = 2 105 / 4 =5
104 s.
Tenir compte du rendement : 5 104 /0,5 =105
s ou environ 28 h.
|
.
|
|
L'eau de Javel est une solution de chlorure de sodium et d'hypochlorite
de sodium Na+ + ClO-.
Donnée : pKa( HClO / ClO-) =7,3.
Ecrire
la réaction de l'ion hypochlorite avec l'eau.
ClO-aq +H2O = HClO + HO-aq.
On prépare une solution d'hypochlorite de sodium de concentration
molaire initiale 5 10-4 mol/L. La concentration finale en
ion hydroxyde est 1,0 10-5 mol/L.
La
solution est-elle acide ou basique ?
[H3O+]=10-14 / [HO-] =10-14
/ (1 10-5)=1,0 10-9 mol/L ; pH =-log(1,0 10-9)
=9, valeur supérieure à 7, la solution est basique.
Comment
retrouve-t-on la constante d'acidité de l'acide hypochloreux à
partir des données ci-dessus ?
[HClO] = [HO-] =1,0 10-5 mol/L ; [ClO-aq]=5
10-4 -1,0 10-5 =4,9 10-4 mol/L.
HClOaq +H2O =ClO-aq +H3O+aq.
Ka =[ClO-aq][H3O+]/
[HClOaq] = 4,9 10-4*1,0 10-9/ 10-5=4,9
10-8 ; pKa = - log(4,9 10-8)
=7,3.
On ajoute de l'acide chlorhydrique à la solution d'eau de javel de
telle sorte que le pH vaut 2. Il se produit la réaction :
HClO + Cl- +H3O+ --> Cl2(g)
+ H2O.
Quelle
est l'espèce majoritaire dans la solution ?
A pH inférieur au pKa, la forme acide HClO est majoritaire
devanr ClO-.
Quelle
précaution faut-il prendre et pourquoi ?
Travailler sous hotte aspirante, le dichlore est un gaz toxique.
|
|
Quel est le domaine spectral de l'infrarouge ? Quels domaines rencontre-ton à la périphérie de l'infrarouge ?
IR : 750 nm à 1 mm.
Visible : 400 nm à 750 nm ; ondes radioélectriques : 1 mm à 100 km.
Quel type de phénomène physique est responsable de la spectroscopie IR ?
Les vibrations des liaisons de valence sont à l'origine des spectres d'absorption dans l'infrarouge proche.
Citer plusieurs exemples d'applications de la spectroscopie IR ?
Identification d'un composé par analyses fonctionnelle et structurale. Déterminer la composition d'un échantillon.
Rappeler la loi de Beer-Lambert.
La loi de
Berr-Lambert exprime la variation de
l'intensité lumineuse en fonction de la distance
parcourue dans un milieu transparent.
Lorsqu'une lumière monochromatique
d'intensité I0 traverse un milieu
homogène, l'intensité de la lumière
émergente I décroît exponentiellement
lorsque l'épaisseur l du milieu absorbant
augmente.
I = I0 . e (-
al)
a est une constante appelée coefficient
d'absorption, caractéristique du milieu et de la
longueur d'onde considérés.
Dans le cas des solutions, la loi de Beer fait intervenir
les concentrations.
I = I0 . e (-
elc)
où e
est un coefficient caractéristique de la
substance appelé coefficient d'absorbance
(L mol-1
cm-1),
l est
l'épaisseur de la cuve
(cm) et
c la concentration de la solution
(mol/L).
Cette loi est vérifiée lorsque la solution
est de concentration inférieure à : c < 0,1
mol.L-1.
Donner une interprétation des différentes bandes spectrales du spectre IR de l'acide éthanoïque.
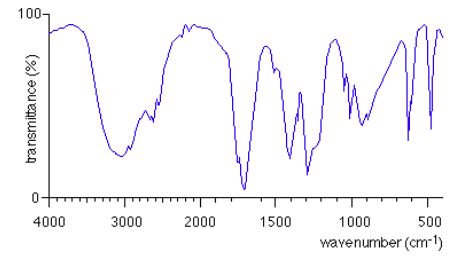
Bande large vers 3000 cm-1 : groupe OH lié par liaisons hydrogène.
Bande forte et fine vers 1700 cm-1 : vibration C=O du groupe carboxyle.
Forte à 1250 cm-1 : élongation C-O.
|
Séparation
des acides phénoliques par chromatographie HPLC en mode gradient
binaire ( la composition de la phase mobile change). Cette technique
permet une très grande séletivité.
Phase mobile A :e au +0,02 % acide trifluoroacétique TFA ; phase mobile B : méthanol +0,02 % TFA.
La phase fixe est apolaire. Silice greffée par des chaines linéaires de 18 atomes de carbone.
Détecteur UV à barette de diode.
L'acide vanillique donne le spectre UV-Visible suivant :
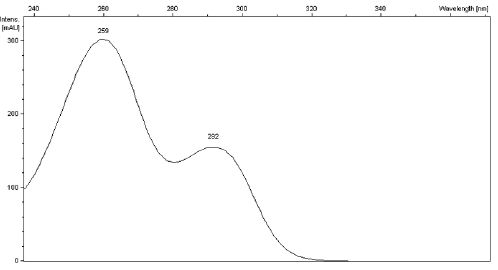
A quelle longueur d'onde feriez-vous la détection ?
Pour une bonne précision on se place à une longueur d'onde
correspondant à une absorption maximale. ( 259 nm). Seul l'acide
vanillique doit présenter un maximum d'absorption à cette longueur
d'onde.
Est-il possible avec ce type de technique analytique de réaliser un dosage ? Si oui, comment procéder ?
Dosage colorimétrique en préparant une gamme étalon et en mesurant l'absorbance pour chaque solution.
Quelle est la différence entre une chromatographie sur colonne et la chromatographie sur couche mince ?
CCM : phase fixe statique ( silice en poudre ) déposée sur un substrat
en aluminium. L'adsorption est la fixation de molécules sur un
substrat. L'utilisation est rapide et précise.
Chromatographie sur colonne : cylindre rempli d'une phase statique ;
elle est lente et on recueille les substances par gravité en bas de la
colonne. Les molécules plus ou moins retenues par la phase fixe
progressent, entraînées par la phase mobile à des vitesses différentes
dans la colonne.
Spectroscopie RMN ( résonance magnétique nucléaire ).
Quel phénomène est à l'origine de la RMN ?
Tous les noyaux atomiques possèdant une charge en rotation ( spin
nucléaire ) sont assimilables à de petits aimants et de ce fait
peuvent présenter un moment magnétique nucléaire.
Sous l'action d'un champ magnétique externe uniforme, le moment
magnétique peut prendre différentes orientations. Pour chaque
orientation correspond un niveau d'énergie :
l'une de basse énergie ( moment magnétique parallèle et de même sens
que le champ extérieur ), l'autre d'énergie plus élevée ( moment
magnétique parallèle et de sens contraire au champ extérieur ).
La différence d'énergie entre ces deux états est proportionnelle au
champ extérieur. Une transition entre ces deux états peut se produire
par absorption d'une radiation. On dit qu'il y a résonance.
La RMN permet de trouver la structure d'un composé.
Quels sont les critères d'un bon solvant en RMN du proton ?
Ce solvant ( CDCl3) doit être aprotique et les molécules organiques doivent y être solubles.
Que signifie TMS et quel est son rôle ?
Tétraméthylsilane Si(CH3)4. Pour apprécier le blindage subit par un proton, il faut une référence.
Les 12 protons équivalents du TMS présentent une absorption intense à
des champs plus forts que dans la plupart des autres protons. Le pic
correspondant est bien séparé à droite de l'enregistrement.
|
|