Atomistique,
chimie des solutions.
Concours technicien 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Atomistique.
Donner le nom des éléments suivants :
N : azote ; S : soufre ; P : phosphore.
Donner le symbole
des éléments suivants :
Argent : Ag ; carbone : C ; or : Au.
Donner
la composition en protons, neutrons et électrons des atomes et ions
suivants :
10747Ag
: 47 ptotons ; 47 électrons et 107-47 = 60 neutrons.
189F- :
9 protons ; 10 électrons et 18-9 = 9 neutrons.
2412Mg2+
: 12 protons ; 10 électrons et 24-12=12 neutrons.
Dans
cette liste des nucléides, quels sont les isotopes ?
10246Pd ; 21D
; 10242Ru
; 10646Pd
; 11H ; 31H.
D'une part :10246Pd
; 10646Pd.
D'autre part : 21D ;
11H ; 31H.
Quelles
configurations électroniques suivantes sont correctes ?
Sodium K2L9. Faux. K2L8M1.
Calcium
: K2L8M8N1.
Faux. K2L8M8N2.
Chlore
: K2L8M7.
Vrai.
Ecrire la
configuration électronique de l'oxygène dans son état fondamental.
K2L6ou
1s2 2s2 2p4.
Quelle
structure de Lewis de l'azote est-elle correcte ?
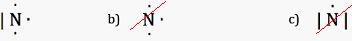 Indiquer
si les affirmations suivantes sont correctes ou incorrectes
Indiquer
si les affirmations suivantes sont correctes ou incorrectes :
L’énergie de première ionisation d'un atome est l'énergie minimale à
fournir à un atome à l'état gazeux pour lui arracher un électron. Vrai.
Les éléments de l’avant dernière colonne de la classification
périodique forment la famille des alcalins. Faux. Halogènes.
L’électronégativité d'un élément est égale à l'énergie ( libérée ou à
fournir ) qui accompagne l'attachement d'un électron à un atome neutre
en phase gazeuse pour devenir un anion. Faux.
L'affinité électronique d'un élément est égale à
l'énergie libérée qui accompagne l'attachement d'un
électron à un atome neutre en phase gazeuse pour devenir un anion.
L’énergie de
seconde ionisation d'un atome est
l'énergie minimale à fournir à un atome à l'état gazeux pour lui
arracher 2 électrons. Faux.
L’énergie de seconde
ionisation d'un atome est
l'énergie minimale à fournir à un atome à l'état gazeux qui a déja
perdu un électron pour lui
arracher un autre électron.
Les éléments de
la seconde colonne de la classification périodique forment la famille
des alcalino-terreux. Vrai.
|
| .
. |
|
|
Classer les 3
éléments F, Li, C par ordre croissant d'énergie de première ionisation.
Les énergies de première ionisation croissent de gauche à droite dans
une période : Li , C , F.
Classer les 3
éléments Mn, N, Sr par ordre croissant d'électronégativité.
Le minimum est en bas à
gauche du tableau et le maximum en haut à droite : Sr, Mn, N.
Donner
le schéma de Lewis des espèces suivantes.
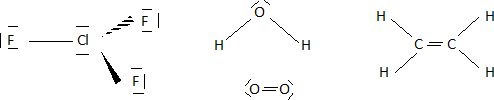
Parmi
les molécules suivantes quelles sont celles qui sont linéaires ?
BeCl2 ; H2O ; C2H2 ; SO2.
BeCl2 et C2H2
sont linéaires.
Le moénocinol est un composé lipidique dont la structure est
représentée ci-dessous.
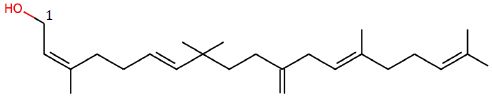
Donner
sa formule brute. C25H42O.
Quel
est le nom du groupe porté par le carbone1 ? Hydroxyle, fonction
alcool primaire.
La
molécule comporte-t-elle des carbones asymétrique ? Si oui, combien
?
Aucun atome de carbone tétragonal lié à 4 atomes ou groupes d'atomes
différents.
La
configuration écrite de la molécule est-elle ?
E E E ; E E Z ; E Z E ; E Z Z ; Z E E ; Z E Z ; Z Z E ; Z Z Z.
|
.
|
|
Vous souhaitez connaître le pH d'une solution.
Citer
deux techniques permettant d'effectuer cette mesure.
Papier indicateur universel de pH ( mesure peu précise ) et utilisation
d'un pHmète ( mesure précise ).
Vous trouvez que le pH de la solution est 8. La solution est-elle
acide, basique,
neutre ?
à 25°C une solution est basique si son pH est supérieur à 7.
Vous préparer une solution d'acide éthanoïque ( pKa = 4,8)
de concentration c = 0,01 mol/L.
Donner la formule
semi-développée de cet acide. CH3-COOH.
Quel
type de liaison lie les atomes de cette molécule ? Liaison
covalente.
Calculer
le pH de cette solution.
pH = pKa - log c = ½(4,8 -log 0,01 )= 0,5(4,8+2) = 3,4.
On ajoute progressivement quelques gouutes d'une solution d'hydroxyde
de sodium très concentrée. Donner la formule de
l'hydroxyde de potassium.
KOH ; K+aq + HO-aq.
Quel type
de liaison lient les espèces présentes dans ce sel ? Liaison
ionique.
Quelle
réaction acide base a lieu pendant l'ajout de la solution de potasse
?
CH3COOH aq +HO-aq --> CH3-COO-aq
+ H2O.
Comment
varie le pH ?
Le pH croît de 3,4 a une valeur un peu supérieure à 7 ( présence de la
base CH3-COO-aq ).
Etudions la réaction suivante : 2H2O = H3O+aq
+ HO-aq.
Comment
s'appelle -t-elle ? Autoprotolyse de l'eau.
Donner
la formule du produit ionique de l'eau.
[ H3O+aq][HO-aq] =Ke = 10-14
à 25°C.
Quel
est le pH d'une solution d'eau pure ?
A 25°C le pH d'une solution d'eau pure est égal à 7.
Convertir
25°C en K et 1 bar en pascal.
T = 273+25 = 298 K et P ~105 Pa.
Dans les conditions normales de température et de pression on souhaite
connaître la densité du dichlore gazeux.
Quelle
formule utilisez-vous ? M = 29 d ; d = M/29 = 71 / 29 = 2,45.
Le
dichlore est-il plus lourd ou plus leger que l'air ? Justifier.
Un gaz dont la densité est supérieure à 1 est plus lourd que l'air.
Enoncer
la loi des gaz parfait en expliquant les termes et en précisant les
unités.
PV = nRT avec pression P en pascal, volume V en m3, n :
quantité de matière en mol ; T : température en kelvin et R = constante
= 8,32 J K-1 mol-1.
Etudions la réaction suivante dont l'équation est incomplète :
MnO4-aq + ... +H2C2O4aq
--> Mn2+aq +... +CO2aq.
Comment
se nomme ce type de réaction ? Oxydoréduction.
Sachant qu'elle se déroule en milieu acide, compléter l'équation
bilan.
Réduction de l'oxydant : 2 fois {MnO4-aq
+8H+aq + 5e- = Mn2+aq +4H2O
}.
Oxydation du réducteur : 5 fois {H2C2O4aq
= 2H+aq + 2e- +2CO2aq}.
Ajouter et simplifier : 2MnO4-aq
+16H+aq + 10e- +5H2C2O4aq
= 2Mn2+aq +8H2O+10H+aq + 10e-
+10 CO2aq.
2MnO4-aq +6H+aq +5H2C2O4aq
= 2Mn2+aq +8H2O +10 CO2aq.
le dégagement gazeux trouble l'eau de chaux. Ecrire l'équation de
la réaction correspondante.
Ca2+aq +2HO-aq + CO2aq = CaCO3(s)
+ H2O(l).
|
|
Etudions
la réaction suivante :
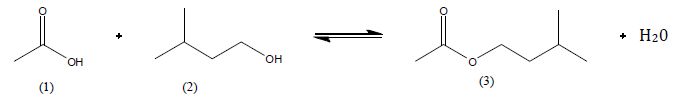
Comment
se nomme ce type de réaction ?
Estérification limitée par l'hydrolyse de l'ester.
Nommer les réactifs
et les produits.
(1) acide éthanoïque ( ou acétique ) ; (2)
3-méthylbutan-1-ol ; (3) ; éthanoate de 3-méthylbutyle.
On ajoute quelques gouttes d'acide sulfrique
comme catalyseur.
Donner
la définition d'un catalyseur.
Un
catalyseur augmente la vitesse d'une réaction sans intervenir dans le
bilan global.
Etudions la réaction suivante : ZnCl2aq + 2NaOHaq-->
Zn(OH)2 (s) + 2NaCl aq.
Comment se nomme ce
type de réaction ? Précipitation.
Exprimer la vitesse
v de la réaction en fonction de la variation de la concentration des
espèces. Préciser les unités de v.
v = 1/V dx/dt avec V : volume (L) de la solution, x avancement (mol); v
= vitesse en mol L-1 s-1.
[NaCl
aq]
=2x / V ; v = ½d [NaCl
aq]/dt.
[ZnCl2aq] =c0-x ; v = -d[ZnCl2aq]/dt.
[NaOH] =c'0-2x ; v = -½d[NaOH]/dt.
Intervalle de confiance [0,512 ; 0,559]
Quelle est la valeur
de cette vitesse à l'équilibre ?
La composition du mélange à l'équilibre est
constante. la vitesse de la réaction est nulle.
On veut détecter la présence de chlorure dans un lot d'eau polluée
grâce au chlorure d'argent AgCl qui est très peu soluble dans l'eau. La
constante associée à la réaction vaut 10-10.
Ecrire la réaction de dissolution de AgCl dans l'eau distillée.
AgCl(s) = Ag+aq +Cl-aq.
Ecrire la constante d'équilibre de cette réaction.
K = 10-10 = [Ag+aq][Cl-aq].
Calculer la concentration en chlorure dans la solutuion dans le cas d'une solution saturée en AgCl.
[Ag+aq]=[Cl-aq]=K½ = 10-5 mol/L.
On introduit maintenant une concentration de nitrate d'argent de 0,001 mol/L dans l'eau polluée.
Comment peut-on détecter la présence de chlorure ?
Formation d'un précipité blanc de chlorure d'argent.
Quelle est la quantité minimale de chlorure que l'on peut détecter ?
[Cl-aq]=K/ [Ag+aq]= 10-10 / 0,001 = 10-7 mol/L.
|
|
|