Métallurgie
du titane ; dureté d'une eau ; synthèse de l'éthanol. Concours
technicien de l'industrie et des Mines
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Métallurgie
du titane.
Le minerai est tout d'abord transformé en dioxyde de titane TiO2.Cet
oxyde réagit à 800 °C sous atmosphère inerte avec du dichlore en
présence de carbone pour donner du tétrachlorure de titane TiCl4
et du monoxyde de carbone.
TiO2 + 2Cl2 +2C
---> TiCl4 + 2CO.
Donner
la struture électronique de l'atome de chlore. Z = 17.
1s2 2s2 2p6
3s2 3p5.
Donner
le schéma de Lewis de la molécule de dichlore.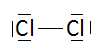
Le tétrachlorure de titane est ensuite réduit par le magnésium, sous
vide à 800°C. Les produits de la réaction sont le titane et le chlorure
de magnésium MgCl2. Ecrire
l'équation de la réaction.
TiCl4 + 2Mg ---> Ti + 2MgCl2.
Montrer
que le magnésium est le réducteur.
Le degré d'oxydation du magnésium passe de zéro dans Mg à + II dans MgCl2.
Le magnésium réducteur s'oxyde.
Une usine produit m=200 tonnes de titane.
Déterminer
les masses de magnésium, de dioxyde de titane et de carbone
nécessaires. .
Quantité
de matière de titane n = m / M(Ti) = 200 106/
47,9 = 4,175 106 mol.
Quantité de matière de magnésium : 2 n ; masse de magnésium : 2n M(Mg)
=2*4,175 106 *24,3
=2,03 108 g =203 t.
Quantité de matière de TiO2
: n ; masse de TiO2 : n M(TiO2) =4,175 106 *79,9
=3,34 108 g =334 t.
Quantité de matière de carbone
: 2n ; masse de TiO2 : 2 n M(C2) =2*4,175 106 *12
=1,00 108 g =100 t.
Dureté
d'une eau. La dureté d'une eau est due à la présence d'ions calcium et magnésium. Le degré hydrotimétrique °TH est définie par :
°TH = ([Ca2+] + [Mg2+]) / 10-4.
L'eau est dure si son degré hydrotimétrique est supérieur à 25.
Citer quelque(s) inconvénient(s) de l'isage industriel ou domestique d'une eau dure. Les canalisations s'entartrent ; les savons sont moins efficaces.
Ecrire l'équation de dissolution du carbonate de calcium CaCO3 dans l'eau.
CaCO3(s) = Ca2+aq + CO32-aq.
Calculer la solubilité du carbonate de calcium à 25°C si son produit de solubilité vaut Ks = 4,0 10-9.
La solution est électriquement neutre [Ca2+aq]=[CO32-aq]= s = Ks½ = (4,0 10-9)½=6,3 10-5 mol/L.
La solubilité du carbonate de calcium vaut 4,1 10-5 mol/L à 85 °C.
En déduire l'influence de la température sur les dépôts calcaires.
La
solubilité du carbonate de calcium diminue si la température augmente.
Les dépôts calcaires se dissolvent moins dans l'eau si la température
s'élève.
|
| .
. |
|
|
La
détermination de la dureté s'effectue à partir d'une grande quantité
d'eau à laquelle on ajoute une solution tampon pH=9 et un
indicateur coloré le NET( noir ériochrome ). En présence d'ion calcium
et magnésium, la coloration rouge est due à la formation d'un complexe.
En l'absence d'ions, la couleur de l'indicateur est bleue. On verse une
solution d'EDTA de concentration 1,0 10-2 mol/L, dans un
volume de 100 mL d'eau. On observe le changement de couleur du
rouge au bleu pour un volume d'EDTA versé de 22 mL. La réaction se fait
mole à mole.
Faire un schéma du dispositif expérimental de titrage.
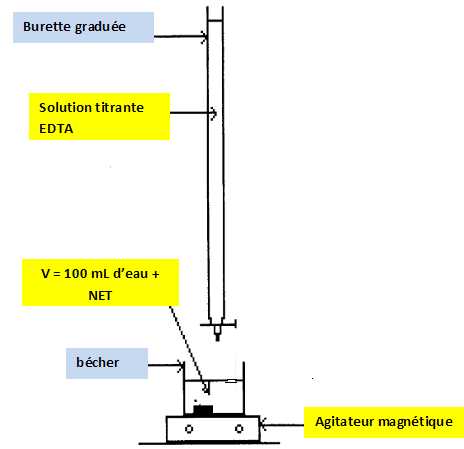
Calculer la concentration totale en ion calcium et magnésium.
Quantité de matière d'EDTA àl'équivalence : 22 10-3 *1,0 10-2 = 2,2 10-4 mol.
Quantité de matière d'ion calcium et magnésium : 2,2 10-4 mol.
[Ca2+] + [Mg2+] =2,2 10-4 /0,100 = 2,2 10-3 mol/L.
Calculer la dureté de l'eau et conclure.
°TH = 2,2 10-3 /10-4 = 22, valeur inférieure à 25 ; l'eau n'est pas dure.
|
.
|
|
Synthsèse de l'éthanol.
On fabrique l'éthanol par hydratation de l'éthène en phase gazeuse en
présence d'un catalyseur. Cette réaction conduit à un équilibre de
constante K.
C2H4+H2O = C2H5OH.
Ecrire l'équation bilan en utilisant les formules développées.
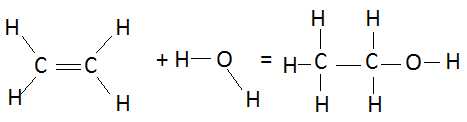
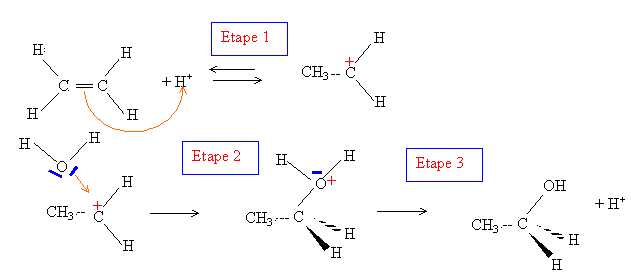
Cette réaction est-elle une addition ou une substitution ? Donner le mécanisme de cette réaction.
Addition sur la double liaison ; à partir de deux espèces, on en obtient une seule.
Exprimer la constante d'équilibre K en fonction des pressions partielles.
K = Péthanol / (PH2O Péthène)
Les réactifs sont introduits en proportions stoechiométriques. On appelle rendement a le nombre de moles d'éthanol formé par mole d'éthylène initial.
Montrer que K s'exprime sous la forme : K = a(2-a)/ (P(1-a)2). P est la pression totale.
| avancement (mole) | éthène | +eau | = éthanol | | initial | 0 | n | n | 0 | | à l'équilibre | x | n-x | n-x | x |
Pressions partielles à l'équilibre : Péthène =Peau =( n-x)P / (2n-x) ; Péthanol =xP /(2n-x).
a = x/n ; Péthène =Peau =(1-a)P / (2-a) ; Péthanol =aP /(2-a). K =a(2-a) / (P(1-a)2)
Quelle est l'influence sur la valeur du rendement :
- d'une élévation de température isobare.
L'enthalpie standard de la réaction à 400 K vaut -42,7 kJ/mol.
Une
réaction exothermique est favorisée par une diminution de la
température. L'équilibre va évoluer dans le sens indirect et le
rendement va décroître.
- d'une élévation de pression isotherme.
Une
augmentation de pression isotherme déplace l'équilibre dans le sens
direct, évolution dans le sens d'une diminution du nombre de moles. Le
rendement croît.
|
|
|