Analyse
élémentaire, RMN du proton.
Concours général 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
L'analyse
qualitative de l'acide crotonique noté A n'a révélé la présence que de
carbone, d'hydrogène et d'oxygène. Afin de déterminer les quantités de
chacun de ces éléments, on effectue une oxydation complète à l'air,
d'une masse mA =0,910 g du composé A ( M = 86,0 g/mol). Dans
les CNTP, on recueille VCO2 = 0,950 L et mH2O =
0,572 g.
Ecrire l'équation
bilan de cette combustion.
CxHyOz + (x+0,25y-0,5z)O2 =
x CO2 + ½yH2O.
En
déduire les quantité de matière de dioxyde de carbone et d'eau formées
en fonction de x et y.
Masse molaire m = 12x+y+16z ; quantité de matière de
A : n = mA/M.
Quantité de matière de dioxyde de carbone : n x = x mA/M =x mA/(12x+y+16z) ;
quantité de matière d'eau : 0,5 n y = 0,5y mA/(12x+y+16z).
Déterminer
la quantité de matière de dioxyde de carbone. En déduire x. Vm
= 22,4 L/mol.
n x =VCO2
/Vm =0,950 / 22,4 =4,24 10-2 mol.
Or n = mA/M = 0,910 / 86,0 =1,06 10-2 mol.
Par suite x = 4,24 /1,06 = 4.
En
utilisant la masse d'eau formée, déterminer y.
Quantité de matière d'eau : mH2O
/MH2O
=0,572 / 18 = 3,18 10-2 mol.
0,5 n y =3,18 10-2
; 0,5 y = 3,18 10-2
/(1,06 10-2)= 3 ; y =
6.
En
déduire z et la formule brute de A.
86,0 = 12 x +y +16 z ; 86,0 = 12*4 +6 +16 z ; z = 2 ; C4H6O2.
|
|
|
Structure de
l'acide crotonique.
Le composé A est un acide carboxylique conjugué.
Rappeler
la nature de la fonction acide carboxylique ; qu'est-ce qu'une molécule
conjuguée ?
Molécule dans
laquelle il y a une succession de liaison simple et double alternée.
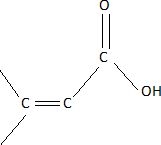
En déduire les deux
formules semi-développées possibles pour A. Donner également les formes
topologiques de ces composés.
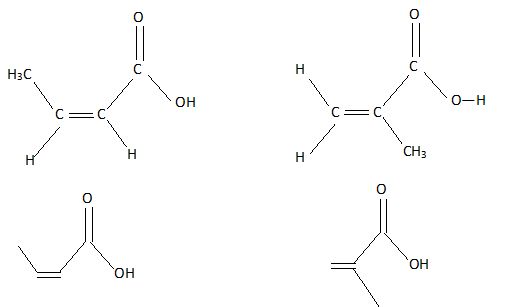
|
| ..
.. |
.
|