Chloral,
acide salicylique, acide benzoïque, méthylamine. Concours
Puissance 11 ( Fesic )
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Exercice
8.
Certains
pays autorisent l'utilisation de I'hydrate de chloral comme sédatif.
Celui-ci est obtenu en réalisant 1'hydratation en milieu acide du
chloral selon la réaction bilan :

Donnée : l'électronégativité du chlore et de l'oxygène est supérieure à
celle du carbone.
a)
Cette réaction est une réaction de substitution. Faux.
Une liaison
double disparaît et deux liaisons simples sont créées.
b)
Dans le spectre RMN de l'hydrate de chloral, on observerait 3 signaux.
Faux.
Les deux
hydrogènes des groupes hydroxyles sont équivalents.
Le mécanisme de la réaction correspondant à l'hydratation du chloral
est le suivant :
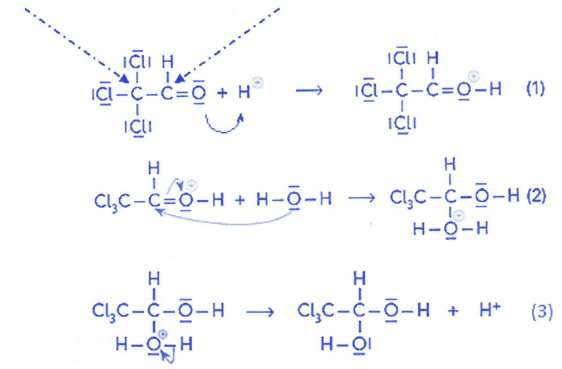
c)
Les atomes de carbone, désignés par les flèches en pointillées, sont
des sites accepteurs d'électron. Vrai.
Le chlore et
l'oxygène sont plus électronégatifs que le carbone.
d) Les ions
hydrogène provenant de l'acide jouent le rôle de catalyseur. Vrai.
Ils sont
régénérés lors de la dernière étape.
|
|
|
Exercice
9.
Le pH d'une solution d'acide
salicylique, de concentration molaire c=2,6.10-3
mol.L-1, est égal à 3. Le volume de la solution
est V= 50,0 mL.
Donnée : constante d'acidité du couple (acide salicylique/ion
salicylate) : Ka= 10-3.
a)
La solution est acide. Vrai.
b)
La réaction est totale. Faux.
L'acide
salicylique est un acide faible. Sa réaction avec l'eau est
partielle.
c)
Dans la solution, l'espèce majoritaire est l'acide salicylique. Faux.
pKa = -log 10-3 = 3. A pH = pKa
, [acide salicylique] = [ion salicylate].
d)
L'avancement à l'équilibre est xeq= l0-3
mol. Faux.
|
avancement
(mmol) |
AH |
+H2O |
=A- |
+H3O+ |
| initial |
0 |
Vc =0,13
mmol |
solvant |
0 |
0 |
| en cours |
x |
0,13-x |
x |
x |
| à
l'équilibre |
xéq |
0,13-xéq |
xéq |
xéq |
Ka
=(xéq /V)2/ ((0,13-xéq)
/V) =x2éq/ ((0,13-xéq)V) ;V Ka(0,13-xéq) =x2éq.
x2éq + V Kaxéq - 0,13 VKa =0
; x2éq + 0,050 xéq - 0,0065 =0.
D
= 0,052+4*0,0065 =0,0285 ; xéq
=½(-0,05 +0,169) =0,059 mmol.
[H3O+]=0,059
/50 ~0,0012 ; pH éq =-log 0,0012 = 2,92 ~ 3.
=0,050 10-pH
=0,05*10-3 =5,0 10-5 mol.
|
.
|
|
Exercice
10.
Un technicien prépare deux solutions, l'une d'acide salicylique
concentration molaire des deux solutionsest égale à 0,010 mol / L.

a)
Le pH de la solution d'acide salicylique est égal à 2,0. Faux.
pH ~½(pKa -log c) ~0,5(3,0 -log0,010) =2,5.
b)
L'acide benzoique et l'acide salicylique sont des isomères. Faux.
Ils ne
possèdent pas la même formule brute.
c)
Le pH de la solution d'acide benzoique est supérieur à celui de la
solution d'acide salicylique. Vrai.
A concentration égale,
l'acide le plus fort est celui qui a le plus petit pKa. L'acide benzoïque étant le
plus faible, le pH de sa solution est supérieur au pH de la solution
d'acide salicylique.
d)
A pH = 4,2, la concentration molaire de l'acide benzoique est égale à
celle de sa base conjuguée. Vrai.
A pH = pKa, [acide benzoïque ] =
[ion benzoate ].
|
|
|
Exercice 11.
On réalise le titrage pH-métrique d'un volume V1= 25,0 mL d'une solution aqueuse de méthylamine CH3NH2(aq) de concentration c1 inconnue par l'acide chlorhydrique (H3O+ + Cl-(aq)) de concentration
c2=0,100 mol.L-1. L'évolution du pH en fonction du volume V2 d'acide chlorhydrique ajouté est donnée ci-dessous : 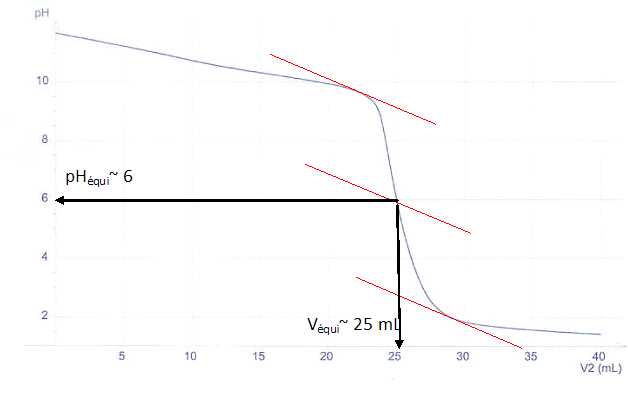
a) La méthylamine est une base de Brönsted. Vrai.
b) A l'équivalence, les espèces majoritaires sont l'eau et les ions oxonium H3O+. Faux.
CH3NH2aq + H3O+aq ---> CH3NH3+aq +H2O.
L'eau et l'ion méthylammonium sont majoritaires à l'équivalence.
c) L'indicateur coloré le plus approprié pour ce titrage est le rouge de bromophénol. ( zone de virage ,2 ; 6,8 ). Vrai.
La zone de virage de l'indicateur coloré doit contenir le pH à l'équivalence.
d) La concentration c1 de la solution de méthylamine est égale à 0,050 mol/L. Faux.
A l'équivalence : c1V1 = c2 Véqui ; c1 = c2 Véqui / V1=0,100 *25 /25 =0,10 mol/L.
|
|
|



