L'acide
salicylique
: sujet ASPF ( acueil, savoir, partage, francophonie) 2009
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
La reine des prés (Filipendula Ulmaria ou spirée) est
une plante vivace des zones humides. Sa tige, haute de 50 cm à 1,50 m,
est surmontée d'une grappe de fleurs, de couleur crème, au parfum doux.
Les fleurs contiennent de l'acide salicylique ou acide spirique (acide
2-hydroxybenzoïque) connu pour ses propriétés inflammatoires et son
action apaisante lors de douleurs articulaires.
On prépare un volume V d'une solution aqueuse d'acide
salicylique de concentration molaire en soluté apporté C = 1,0 10 -2
mol.L -1. On mesure le pH de la solution à 25°C : pH = 2,5.
Aide au calcul : log (2,5) = 0,4 ; log (1,3) = 0,1 ; 10 0,5
= 3,2 ; 10 -0,5 = 0,32 ; 138*7,25 =100.
Définir
un acide au sens de Brönsted.
Un acide est une espèce, ion ou molécule, susceptible de céder un
proton H +.
L’acide salicylique réagit avec l’eau. En utilisant la notation HA(aq) pour l’acide salicylique, on donne l’équation
chimique de cette réaction :
HA(aq) + H2O = A- (aq) + H3O+(aq)
Compléter le tableau d’évolution suivant :
|
avancement (mol)
|
AH
|
+H2O
|
= A-
|
+H3O+
|
|
initial
|
0
|
n0=CV
|
solvant en large excès
|
0
|
0
|
|
en cours
|
x
|
CV-x
|
x
|
x
|
|
final ( réaction
réelle)
|
xf=V 10-pH
=V 10-2,5
|
CV-xf
|
xf
|
xf
|
|
final ( si réaction totale)
|
xmax =CV
=10-2 V
|
CV-xmax
|
xmax
|
xmax
|
On définit le taux d’avancement final tf de cette réaction par le rapport xf / xmax. Calculer tf ; conclure.
tf =10-2,5 / 10-2 =0,316 ~0,32.
Ce taux étant inférieur à 1, la réaction de l'acide salicylique avec l'eau est partielle.
|
| ... |
|
|
Le quotient de réaction à l’équilibre Ka=Qr,éq est défini par la relation :
Ka =
[A-]éq
[H3O+]éq
/ [AH]éq
Calculer Ka.
[A-]éq =
[H3O+]éq
= t c ;
[AH]éq = (1-t)c
Ka =t
2c / (1-t)
=0,322 * 10-2 / (1-0,32) =1,5
10-3 soit pKa = 2,8.
Comment nomme-t-on ce quotient de réaction à l’équilibre ? Sa valeur dépend-elle des conditions initiales ?
La constante d'acidité ne dépend que de la température ; elle est indépendante des conditions initiales.
|
.
|
|
On désire vérifier par titrage la
composition d'une solution d'acide salicylique
achetée en pharmacie aux propriétés
verrucides par application locale.
L'étiquette
indique : 10 g d'acide salicylique pour 100 mL de
solution.
On dilue 10 fois la solution pharmaceutique puis on
prélève 20,0 mL de cette solution
diluée que l'on dose par une solution aqueuse
d'hydroxyde de sodium (Na+(aq) +
HO-(aq)) de concentration molaire en
soluté apporté Cb = 0,10
mol.L-1. On note le pH du mélange
réactionnel après chaque ajout de solution
d'hydroxyde de sodium, ce qui permet de tracer la courbe pH
= f(Vb) et d'en déduire la courbe
dérivée.
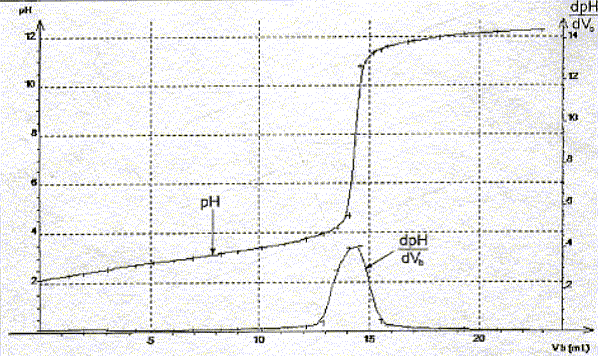
Ecrire l'équation
chimique de la réaction entre la solution d'acide
salicylique, noté HA(aq), et la solution d'hydroxyde
de sodium.
HA aq + HO- aq =
A-aq + H2O(l).
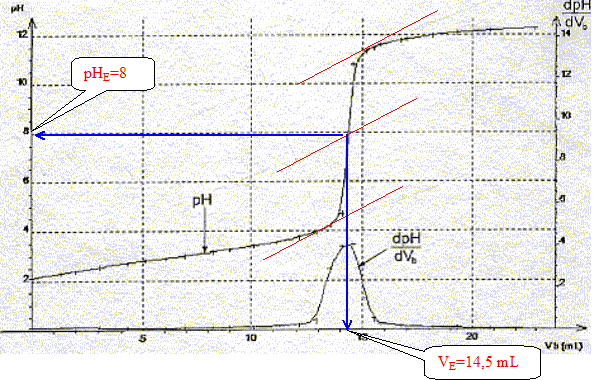
Utiliser les courbes
données pour déterminer les coordonnées
du point
équivalent.
|
|
|
En déduire la
concentration molaire en acide salicylique de la solution
diluée puis de la solution
pharmaceutique.
c vA= cb VE soit c
= cb VE / vA=0,10*14,5 / 20
= 7,2 10-2 mol/L.
La solution pharmaceuthique est 10 fois plus
concentrée soit : 7,2
10-1 mol/L.
Le titrage peut être réalisé plus rapidement en utilisant un indicateur coloré. Choisir, dans la liste proposée ci-dessous, un indicateur convenable, en justifiant la réponse..
|
indicateur
|
hélianthine
|
rouge de bromophénol
|
bleu de bromothymol
|
rouge de crésol
|
phénolphtaléine
|
|
zone de virage
|
3,1 ; 4,4
|
4,8 ; 6,4
|
6,0 ; 7,6
|
7,2 ; 8,8
|
8,2 ; 10,0
|
La zone de virage de l'indicateur coloré doit
contenir le pH du point équivalent ( pH= 8 dans ce
cas) : donc le rouge de
crésol est le plus approprié.
|
|
|

