Etude de l'estérification
Deux étudiants décident de refaire les expériences réalisées en 1862
par les chimistes Marcellin Berthelot et Léon Péan de Saint-Gilles,
concernant la réaction d'estérification à partir de l'acide éthanoïque
CH
3-COOH
et de l'éthanol CH
3-CH
2OH.
Ils préparent dix ampoules identiques. Ils introduisent dans chaque
ampoule 0,10 mol de chacun des réactifs.
Les ampoules sont fermées hermétiquement et placées dans une enceinte à
température constante de 100°C, à
une date prise comme date initiale (t= 0).
A une date t donnée, ils sortent une ampoule de l'enceinte, la
refroidissent rapidement et effectuent un dosage
de l'acide éthanoïque restant avec une solution titrée d'hydroxyde de
sodium en présence de phénolphtaléine.
Le tableau donné ci-dessous donne les résultats des dosages successifs.
Résultats des dosages des dix ampoules: quantité de matière d'acide éthanoïque (n) en fonction de la date
de prélèvement (t).
Date ( heure)
|
0
|
4
|
10
| 20
|
40
|
100
|
150
|
200
|
250
|
300
|
Quantité de matière n (mmol)
|
100
|
75
|
64
| 52
|
44
|
36
|
35
|
34
|
33
|
33
|
Écrire l'équation de la réaction associée à l'estérification qui se produit dans chaque ampoule. Nommer
l'ester formé.
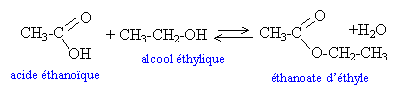 Pourquoi refroidit-on rapidement les ampoules avant chaque dosage
Pourquoi refroidit-on rapidement les ampoules avant chaque dosage ?
On réalise un blocage cinétique : la composition du milieu reste pratiquement constante.
A l'aide du tableau d'avancement de la réaction ayant lieu dans chaque ampoule :
Déterminer l'avancement maximal x
max.
|
avancement (mmol)
|
CH3COOH
|
CH3-CH2OH |
ester
|
+eau
|
initial
|
0
|
100
|
100
|
0
|
0
|
à l'équilibre
|
x
|
100-x=33
|
100-x
|
x
|
x
|
x
max = 100-33 = 67 mmol.