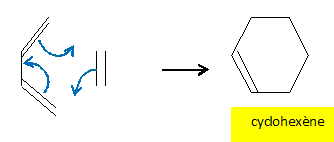L'odorat :
synthèse d'une espèce odorante, le bourbonène.
Concours Capes 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
Le
nez humain est un détecteur de molécules odorantes plus sensible que la
plupart des capteurs physico-chimiques. Les récepteurs situés dans la
partie supérieure de la cavité nasale, interagissent avec les molécules
odorantes, nécessairement volatiles, présentes dans l'air inhalé.
On se propose ici d'étudier quelques étapes de la synthèse d'une espèce odorante : le bourbonène.
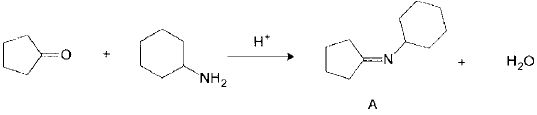
Etape 1 : formation acido-catalysée d'une imine A.
(a1) : activation du groupe carbonyle ; (a2) addition nucléophile de l'amine ; (a3) déshydratation acido-catalysée.
Les événements (a1) et (a2) sont analogues à ceux que l'on observe au cours d'une hémi-acétalisation, et l'événement (a3) est analogue à la deshydratation d'un alcool en milieu acide.
Ecrire le mécanisme de la réaction de la propanone avec le méthanol en milieu acide conduisant à l'hémi-acétal correspondant.
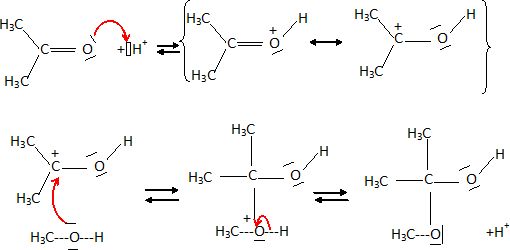
Ecrire
le mécanisme de déshydratation du 2,3-diméthylbutan-2-ol en milieu
acide et en justifiant le produit majoritairement obtenu. 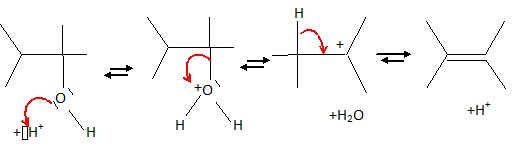 On obtient l'alcène le plus stable ( le plus substitué), le 2,3-diméthylbut-2-ène. ( Règle de Zaitsev).
|
| .
. |
|
|
Proposer
un mécanisme pour la formation de A et interpréter le fait observer
expérimentalement, que la vitesse de cette réaction est faible en
milieu basique mais aussi en milieu acide.
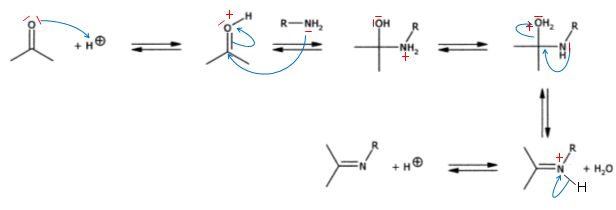
La
réaction est catalysé en milieu acide ( protonation, activation du
carbonyle). Si le pH est trop bas, l'amine est protonée et l'addition
nucléophile ne se produit plus.
|
.
|
|
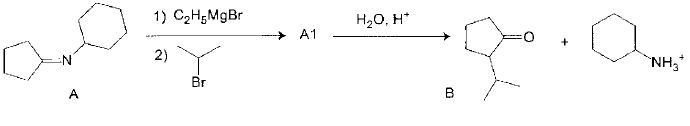
Etape 2.
Les
atomes d'hydrogène portés par les atomes de carbone en alpha du groupe
caractéristique de l'imine présentent une certaine acidité. Ce
phénomène est exploité ici pour créer une nouvelle liaison C-C. Le
produit A1 ainsi obtenu est ensuite hydrolysé selon une réaction inverse de l'étape 1 pour conduire à la cétone B.
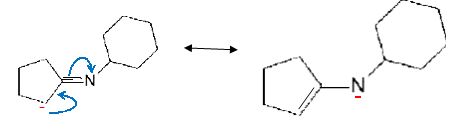
Ecrire
la formule de la base conjuguée de A et, par analogie avec une situation connue, justifier l'acidité de A.
La base conjuguée de A est stabilisée par résonance.
Quel est le rôle joué par l'organomagnésien ? Ecrire l'équation de la réaction correspondante.
L'organomagnésien joue le rôle d'une base forte et arrache le proton en alpha du groupe imine.
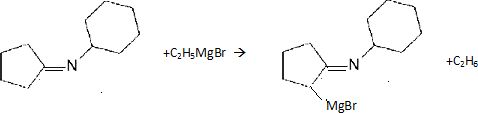
Nommer le type de réaction mise en jeu quand on introduit le 2-bromopropane et représenter la formule du produit A1 de cette réaction.
Substitution nucléophile du second ordre SN2.
Expliquer
pourquoi l'action successive du bromure d'éthylmagnésium puis du
2-bromopropane sur la cyclopentanone n'aurait pas conduit au produit
désiré.
L'organomagnésien
aurait réagit avec le groupe carbonyle pour conduire à un alcool. Le
passage par l'imine est une protection du groupe carbonyle. L'hydrolyse
de l'imine conduit à une cétone.
Troisième étape.
L'anion nucléophile obtenu par réaction de B avec le méthanolate de sodium réagit sur le méthanoate d'éthyle.
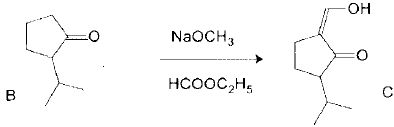
Connaissant le produit final C, indiquer les produits de la réaction entre le méthanolate de sodium et B.
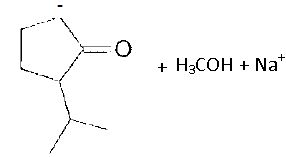
Identifier le nouveau groupe caractéristique présent dans C.
Le groupe énol est stabilisé par résonance.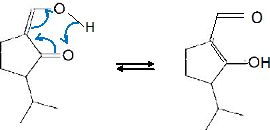
Quatrième étape :
C est traité par LiAlH4 dans l'éther anhydre. On obtient D après hydrolyse.
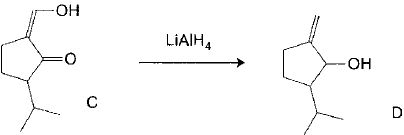
Le spectre IR de C comporte des bandes à 3500 cm-1 ( large), 1735 cm-1, 1670 cm-1et 1605 cm-1 ; celui de D comporte des bandes à 3400 cm-1( large), 1662 cm-1 et 895 cm-1. Le spectre RMN 1H
de C comporte, entre autres, un multiplet intégrant pour 1H à 7,33 ppm
et celui de D comporte, entre autres, deux multiplets intégrant chacun
pour 1 H à 4,95 et 5,11 ppm.
Montrer que le passage de C à D est une réduction. Est-ce cohérent avec l'utilisation de LiAlH4 ? Justifier le choix du solvant.
La disparition de la bande à 1735 cm-1( caractéristique de la liaison C=O) , l'apparition de la bande à 895 cm-1( caractéristique de la liaison RR'C=CH2 ) prouvent la réduction d'une cétone en alcool et d'un énol en alcène. LiAlH4 est un générateur d'hydrures donc un réducteur fort. LiAlH4 réagit violemment avec l'eau et est très soluble dans l'éther anhydre. L'ether est un bon solvant ses espèces organiques.
De plus La RMN indique la présence d'un proton énolique ( d = 7,33 ppm) dans C et la présence de deux protons C=CH2 dans D.( d= 4,95 et 5,11 ppm).
Etape 7.
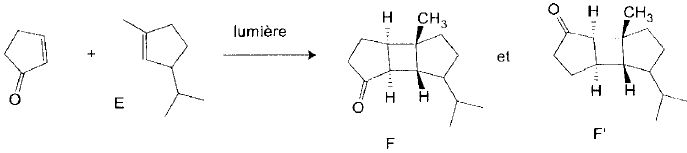
Le spectre RMN 1H de E comporte, entre autres, un multiplet
intégrant pour 1H à 5,21 ppm, un doublet intégrant pour 6 H à 1,77 ppm
et un singulet intégrant pour 3 H à 1,63 ppm.
Attribuer les signaux.
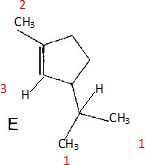
|
1 : 6 protons équivalents, le carbone voisin porte un seul hydrogène ; donc doublet intégrant pour 6 H à 1,77 ppm.
2 : 3 protons équivalents, le carbone voisin ne porte pas d'hydrogène : donc singulet intégrant pour 3 H à 1,63 ppm.
3 : un proton fixé
sur un carbone doublement lié à un autre carbone ; le carbone voisin
porte un proton : donc doublet intégrant pour 1 H vers 5,21 ppm.
|
La réaction de Diels-Alder est une cycloaddition"4+2" thermique entre un diène et un philodiène.
Justifier
l'appellation "4+2" et écrire à l'aide des formules topologiques
l'équation de la réaction entre l'éthène et le buta-1,3-diène.
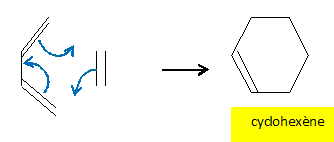
Les 4 électrons p du diène réagissent avec les deux électrons p de l'alcène.
Sur
des réactifs substitués, on met en évidence la stéréosélectivité "
supra-supra" de la réaction. Illustrer cette stéréosélectivité sur un
exemple bien choisi.
|
OM
|
énergie
|
C1
|
C2 |
C3 |
C4 |
C5 |
C6 |
HO
|
a+0,45 ß
|
0,55
|
0,24
|
-0,44
|
-0,58
|
0,26
|
0,20
|
BV
|
a-0,70 ß |
0,60
|
-0,42
|
-0,30
|
0,58
|
-0,15
|
0,08
|
 |
OM
|
énergie
|
O1
|
C2
|
C3 |
C4 |
C5 |
|
HO
|
a+0,86 ß |
0,47
|
-0,07
|
-0,53
|
-0,62
|
0,33
|
BV
|
a-0,36ß |
0,44
|
-0,60
|
-0,23
|
0,63
|
0,07
|
Identifier les OM
permettant l'interaction orbitalaire la plus favorable entre les deux
réactifs ? Justifier.
Il faut que les niveaux des orbitales
frontières de
A et B soient le plus proche possible.
Faisons le calcul de la
différence des niveaux d'énergie :
DE = BV(diène B)
-HO(A) =a-0,70 ß -(a +0,86 ß )= -1,56 ß.
DE = BV(A) -HO(B) =a-0,36 ß -( a+0,45 ß) =
-0,81 ß.
Il y a donc interaction entre
la BV de A et la HO du diène B.
Prévoir
le produit majoritairement obtenu dans l'hypothèse d'un contrôle
orbitalaire.
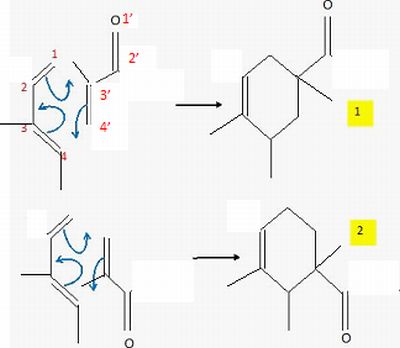
L'une des liaisons se forme
avant l'autre et détermine donc le sens de
la cycloaddition. La liaison qui se forme le plus facilement est celle
reliant les atomes ayant les plus grands coefficients des orbitales
frontières. Le composé obtenu
majoritairement est donc l'isomère 2.
B :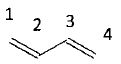
|
OM
|
énergie
|
C1
|
C4
|
HO
|
a+0,62 ß
|
0,60
|
-0,60
|
BV
|
a-0,62 ß |
0,60
|
0,60
|
A :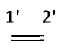 |
HO
|
a+ ß |
0,71
|
0,71
|
BV
|
a- ß |
0,71
|
-0,71
|
Il faut que les niveaux des orbitales
frontières de
A et B soient le plus proche possible.
Faisons le calcul de la
différence des niveaux d'énergie :
DE = BV(diène B)
-HO(A) =a-0,62 ß -(a + ß )= -1,62 ß.
DE = BV(A) -HO(B) =a- ß -( a+0,62 ß) =
-0,38 ß.
Il y a donc interaction entre
la BV de A et la HO du diène B.
.
|
|
|
Etape 8.
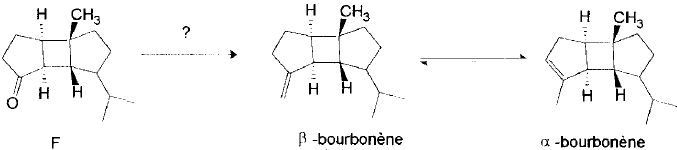
Nommer
la réaction mise en jeu. Indiquer la structure de l'hylure de phosphore
utilisé et la façon de la préparer à partir des produits courants.
La réaction de Wittig ( l'addition d'un ylure de phosphore sur un composé carbonylé ) donne un composé éthylénique.
Préparation de la triphénylphosphine : 3Ph-MgCl + PCl3
---> PPh3 + 3MgCl2.
Substitution nucléophile de la triphénylphosphine sur un dérivé
halogéné dans l'acétone.
PPh3
+CH3I --->Ph3 P+--CH3 + I-.
Ph3 P+--CH3
+ nBuLi ---> Ph3 P+--CH2- + BuH. (
solvant THF ).
[ Ph3 P+--CH2- <---> [Ph3 P=CH2 ].
Le ß-bourbonène s'isomérise en milieu acide en a-bourbonène.
Proposer un mécanisme pour cette réaction et commenter le fait que le mélange à l'équilibre contienne majoritairement l'isomère a.
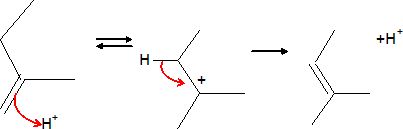
La protonation donne un carbocation tertiaire stable. La perte d'un proton donne un alcène trisubstitué plus stable.
|
|
|