Le toucher : une
chaufferette de poche.
Concours Capes 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
La peau
contient de nombreux thermorécepteurs, terminaisons nerveuses sensibles
au froid ou au chaud qui rendent compte de la température cutanée.
Cette partie étudie un dispositif qui, dans un environnement très
froid, permet de réchauffer les mains par contact : une chaufferette de
poche.
Une chaufferette de poche est une pochette étanche en matière plastique
contenant un liquide incolore visqueux, noté L et une lamelle
métallique. Quand on plie la lamelle métallique, le liquide L se
transforme en quelques secondes en un solide blanc, noté S. La
température de la chaufferette augmente alors spontanément et
rapidement pour atteindre 50 °C, valeur suffisante pour se réchauffer
les mains. On peut ramener la chaufferette dans son état initial en
l'immergeant pendant une durée suffisante dans l'eau bouillante, puis
en la laissant refroidir sans toucher la lamelle.
Fabrication d'une chaufferette.
On peut trouver le mode opératoire de fabrication d'une chaufferette artisanale :
Ingrédients : 35 g de bicarbonate de soude, 0,50 L de vinaigre blanc à
8°C ( solution aqueuse d'acide acétique de fraction massique 0,08 et de
densité égale à 1 ).
Mode opératoire : mélanger le vinaigre et le bicarbonate et quand le
mélange ne mousse plus ajouter 0,50 L d'eau chaude. Porter à ébullition
et laisser évaporer jusqu'à ce qu'il reste environ 10 % du volume
initial. Des cristaux blancs apparaissent : les filtrer, les enfermer
dans une pochette : c'est la chaufferette.
Ecrire l'équation de la réaction mise en oeuvre lors du mélange des ingrédients.
NaHCO3(s) + CH3COOH aq---> CH3COO-aq + Na+aq + H2O + CO2(g).
Expliquer pourquoi le mélange mousse. Du dioxyde de carbone se dégage.
Evaluer le volume de gaz produit au cours du mélange.
Quantités de matière initiales :
M(NaHCO 3) =23+1+12+3*16 =84 g/mol ; n( NaHCO3) = 35/84=0,417 ~0,42 mol.
M(acide éthanoïque) = 60 g/mol ; masse d'acide 0,5*0,08 =0,040 kg = 40 g ; n(acide) = 40/60 =0,67 mol.
L'acide est en excès ; on obtient donc environ 0,42 mol de dioxyde de carbone.
Dans l'hypothèse ou le dioxyde de carbone est considéré comme un gaz parfait et le volume molaire V m = 24 L/mol, le volume de ce gaz est égal à : 0,42*24 ~10 L.
Composition d'une chaufferette.
La chaufferette acheté dans le commerce porte l'indication " contient de l'acétate de sodium, non toxique".
Pour vérifier la présence d'acétate de sodium, on dissout une masse m =
0,487 g de solide S dans l'eau et on réalise un titrage par l'acide
chlorhydrique de concentration molaire 0,100 mol/L. Le titrage est
suivi par pH-métrie. 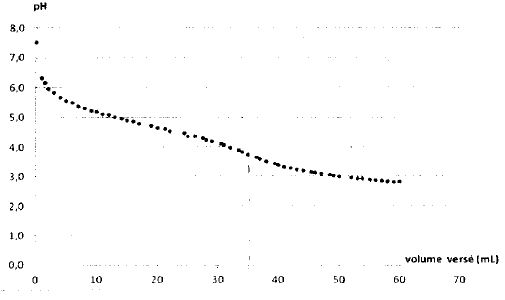
|
| .
. |
|
|
L'équivalence n'étant pas nette sur la courbe brute, on réalise un traitement numérique des mesures qui conduit à attribuer Véq = 35 ±1 mL au volume d'acide versé à l'équivalence.
Montrer que l'allure de la courbe est cohérente avec l'indication de l'emballage.
Initialement la solution contient l'ion hydrogénate. Au cours de l'ajout d'acide chlorhydrique le pH diminue.
Quantité de matière d'acide chlorhydrique à l'équivalence : 35*0,100 = 3,5 ±0,1 mmol.
Quantité de matière initiale d'hydrogénocarbonate de sodium : 3,5 ±0,1 mmol.
Masse molaire NaC2H3O2 anhydre : 82 g/mol. Masse correspondante : 82*3,5 =287 ±8 mg .
Masse molaire NaC2H3O2,3H2O : 136 g/mol. Masse correspondante : 136*3,5 =476 ±14 mg.
La chaufferette contient donc de l'acétate de sodium trihydraté.
Des tables indiquent pour cette forme de l'acétate de sodium une température de fusion de 55°C.
Expliquer pourquoi on peut la conserver liquide à température ambiante et préciser le rôle de la lamelle métallique.
La
solution aqueuse d'acétate de sodium est sursaturée. En tordant la
plaquette métallique à l'intérieur du liquide sursaturé, on libère les
germes d'acétate de sodium solidifié, ce qui déclenche la
cristallisation.
|
.
|
|
Aspect énergétique.
On se propose de quantifier l'énergie libérée par la solidification du
liquide L. Pour cela on met en oeuvre trois méthodes : une
détermination à partir des valeurs des tables et deux déterminations
expérimentales, l'une à l'aide de mesures calorimétriques,
l'autre à l'aide de mesures de températures au début de cristallisation
de solutions de concentrations apportées variables en solide S.
Première méthode : à partir des tables. On suppose que la fusion du solide forme une solution aqueuse ionique d'acétate de sodium.
Ecrire
l'équation de la réaction qui traduit cette transformation et, à partir
des données, déterminer la valeur de l'enthalpie molaire de fusion du
solide S ; commenter son signe.
NaC2H3O2,3H2O (s) ---> Na+aq + CH3COO-aq + 3H2O(l).
DHfusion = DfH°(CH3COO-aq) +DfH°(Na+aq)+3DfH°(H2O (l))-DfH°(NaC2H3O2,3H2O (s)) = -486 -240-3*286-(-1602)=18 kJ/mol.
La fusion du solide est endothermique. La solidification du liquide est exothermique.
Deuxième méthode.
La chaufferette préalablement refroidie à °C est totalement recouverte
de glace, dans un récipient A juste après avoir été activée. Dans un
récipient identique B posé à côté, on place de la glace jusqu'à une
hauteur identique. Deux heures plus tard, les deux récipients
contiennent toujours de la glace, en présence de masses différentes
d'eau liquide. On suppose l'équilibre thermique établi entre la
chaufferette et l'eau. On élimine la glace restante et on mesure la
masse d'eau liquide dans les deux récipients : on trouve mA = 306 g et mB = 214 g. Par ailleurs une pesée de la chaufferette entière donne une masse m1 = 147 g et celle de l'enveloppe et de la lame de métal nettoyées une masse m2 = 8 g.
Déterminer la valeur de l'enthalpie molaire de fusion du solide S.
Le récipient B sert de référence.
L'énergie libérée lors de la solidification du liquide de la chaufferette sert à faire fondre la masse mA -mB de glace.
Energie gagnée par la glace pour fondre : DHfusion glace * mase de glace fondue = 333*(0,306-0,214)=30,6 kJ.
Energie libérée par la solidification de m1-m2 grammes de liquide L : -30,6 kJ pour 0,139 kg soit 139/M(L)=139/82~1,695 mol.
DHsolidification = -30,6 /1,695 ~ -18,05 ~ -18,0kJ /mol. DHfusion = 18 kJ/mol.
Troisième méthode.
On prépare des mélanges de différentes compositions avec le solide S
extrait de la chaufferette et de l'eau. Pour chaque mélange on
détermine par le calcul la fraction molaire x(AcONa) d'acétate de
sodium. On porte chacun de ces mélanges à 80°C et on mesure la
température qs d'apparition des premiers cristaux au cours du refroidissement.
m(S) (g)
|
9,43
|
10,20
|
9,90
|
11,54
|
10,32
|
10,84
|
m(eau) (g)
|
5,93
|
3,98
|
1,93
|
1,63
|
1,04
|
0,56
|
x(AcONa)
|
0,11
|
0,14
|
0,18
|
0,20
|
0,21
|
0,23
|
qs(°C)
|
35
|
41
|
50
|
52
|
53
|
54
|
En
supposant que l'acétate de sodium ne forme pas d'autre hydrate que
celui déja signalé et en utilisant les points expérimentaux du tableau,
tracer l'allure du graphe donnant la température qs en fonction de x(AcONa) pour x compris entre 0 et 0,30.
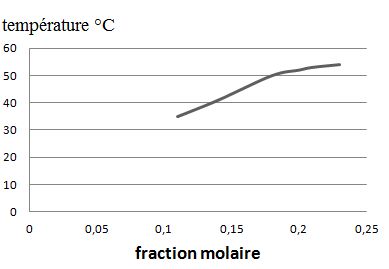
En supposant que le mélange obtenu par chauffage se comporte de façon
idéale, on peut à partir des résultats expérimentaux déterminer la
valeur de la constante K° de l'équilibre de fusion à différentes
températures T ( en K). Une régression linéaire de ln K° en fonction de
1/T donne :
lnK° = a/T + b avec a = -2,4 103 K et b = 2,5.
Déterminer l'enthalpie molaire de fusion du solide S.
DG° = DH°-TDS° = -RTlnK° = -R(a+bT).
Par identification DH° =-Ra = -8,314(-2,4 103) =19,95 103 J / mol ~20 kJ /mol.
A 10 % près les trois valeurs obtenues sont identiques.
|
|
|

