Synthèse d'un antioxydant,
magnésien, régiosélectivité, principe RMN :
Agrégation interne 2014.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
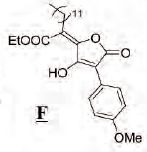
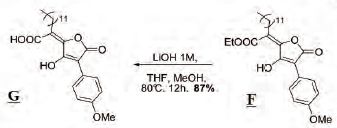
On se propose d'étudier la
synthèse de G : 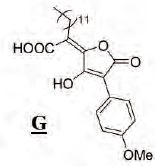 Première étape :
synthèse du cétoester B
Première étape :
synthèse du cétoester B.
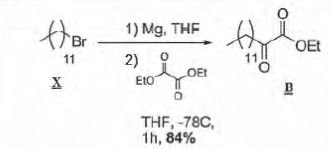
Le bromure de dodécyle X est traité avec du magnésium, puis le produit
formé réagit avec l'oxalate de diéthyle, à -78°C dans le THF. Le
cétoester B est obtenu avec un rendement de 84 %.
Ecrire
les équations des réactions mises en jeu dans les deux étapes de
synthèse de B.
Mg(s) + RBr ---> RMgBr.
RMgBr + EtOOC-OOEt ---> RCO-COOEt + EtOMgBr.
Déterminer
la valeur de l'affinité chimique de la réaction du magnésium solide par
le dioxygène à température et pression ambiantes. Quelle conséquence
pour la synthèse peut-on en déduire ?
Mg(s) + ½O 2(g) ---> MgO(s).
DrH° =
DfH° (MgO(s)) - DfH° (Mg(s)) -½ DfH° (O2(g)) =DfH° (MgO(s)) =-602 kJ/mol.
DrS° = S° (MgO(s)) - S° (Mg(s)) -½ S° (O2(g)).
DrS° =26,9
-32,7-0,5*205 = -108,3 J K-1 mol-1.
DrG°(298)
=DrH° -TDrS° = -602 103
-298 (-108,3) =-5,697 105 J mol-1.
DrG(T)
=DrG°(T)
-RT ln (PO2 /P0)½ avec PO2
= 0,2 bar sous pression ambiante.
DrG(298) =-5,697 105
-8,31 *298 ln 0,2½ = -5,677 105 J mol-1.
A = -DrG(298)
=5,677 105 J mol-1, valeur
positive.
L'oxydation du magnésium évolue spontanément dans le sens direct. Le
magnésium devra être décapé.
Justifier à l'aide
d'un diagramme de prédominance entre autres, les conditions
expérimentales choisies pour cette synthèse.
Le magnésien est une base très forte susceptible de réagir avec un
hydrogène acide : il faut travailler en milieu anhydre et en l'absence
d'espèce protique.
 En
l'absence de THF quel autre solvant peut-on utiliser
pour la synthèse de B
En
l'absence de THF quel autre solvant peut-on utiliser
pour la synthèse de B ?
Le solvant organique doit être aprotique, peu polaire et basique (
selon Lewis ) : ether diéthylique.
Etape 2. Synthèse de l'alcool C. 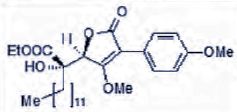
Une solution de n-BuLi ( 1,5 mol/L dans l'hexane, 5,7 mL, 8,52 mmol,
1,5 éq ) dans 10 mL de THF est refroidie à -78°C. L'acide tétronique
protégé A ( 1,25 g, 5,68 mmol, 1 éq ) dans 20 mL de THF est ajouté
lentement. La solution est agitée 30 min à -78°C puis le cétoester B(
3,07 g, 11,36 mmol, 2 éq) est ajouté. Après 30 min d'agitation à -78
°C, la solution est laissée revenir à température ambiante. Après deux
heures d'agitation à température ambiante et ajout d'une solution
aqueuse saturée en chlorure d'ammonium, la phase aqueuse est extraite à
l'acétate d'éthyle. La phase organique est séchée sur sulfate de
magnésium anhydre et concentrée. Le brut réactionnel est purifié par
chromatographie sur gel de silice. L'alcool C ( 2,21 g, 79 %) est
obtenu sous forme d'une huile jaune, mélange de deux diastéréoisomères.
Le spectre RMN 1H ( 300 MHz, CDCl 3) d'un des
deux
diastéréoisomères présente les signaux dont on donne les déplacements
chimiques : 0,81 - 0,84 ( m, 3 H ); 1,22 - 1,48 ( m, 23 H) ; 1,82 -
2,03 ( m , 2H ) ; 3,70 ( s, 3 H ) ; 3,75 ( s, 3 H ) ; 4,25 ( t, J = 6,9
Hz, 2 H) ; 4,87 ( s, J = 8,4 Hz, 2 H ) ; 7,25 ( d, J = 8,4 Hz, 2 H).
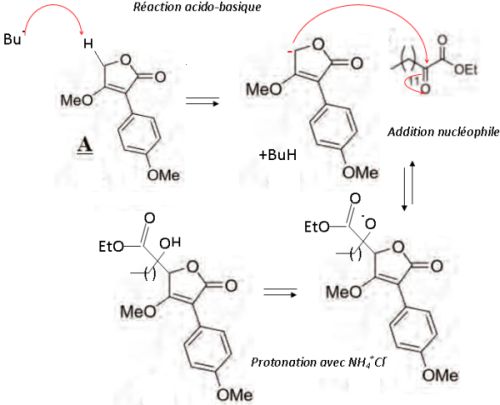
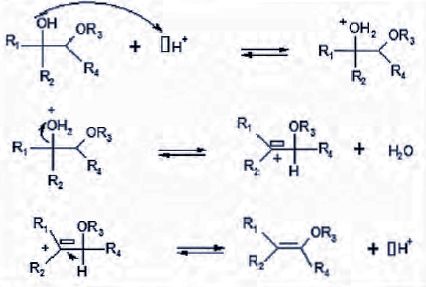
Ecrire
le mécanisme de formation de l'alcool C en justifiant la
chimiosélectivité de la réaction sur le cétoester.
L'addition
nucléophile peut se faire sur la fonction cétone ou sur la fonction
ester ; mais celle-ci est moins électrophile du fait de l'effet
mésomère donneur du groupe OEt.
|
| .
. |
|
|
Préciser les
descripteurs stéréochimiques du stéréoisomère suivant :
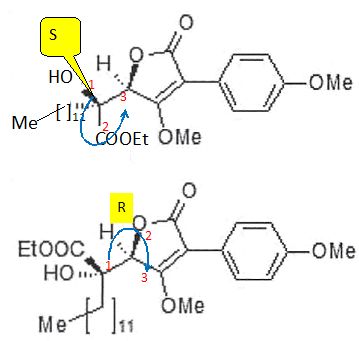
Expliquer le rôle
des différents traitements.
Ajout
de la solution de chlorure d'ammonium : passage de l'alcoolate à
l'alcool sans risque de déshydratation.
Extraction de la phase aqueuse à l'aide d'acétate d'éthyle : récupérer
C dans la phase organique.
Séchage de la phase organique au sulfate de magnésium anhydre :
éliminer les traces d'eau.
Concentrer cette phase : éliminer une partie du solvant organique.
Chromatographie : purifier C en le séparant des différentes espèces
présentes.
Effectuer
une présentation comparative de la CCM sur silice et de la
chromatographie sur colonne de gel de silice.
Ce sont des chromatographies d'adsorption mettant en oeuvre une phase
fixe et une phase mobile ( éluant ).
CCM :
élution par capillarité ; de petites quantités sont mises en oeuvre
mermettant l'analyse ( identifiication et pureté ), plusieurs éluants
sont souvent utilisés successivement afin de récupérer toutes les
espèces.
gel de silice
: élution par gravité d'un éluant unique. C'est une technique de
séparation utilisant de grandes quantités de matière.
Expliquer
le principe de la RMN.
Les spins nucléaires peuvent interagir avec un champ magnétique
extérieur. Les états de spin d'un noyau placé dans un champ magnétique
sont quantifiés. Pour le proton ( spin I = ½) il y a deux états
stationnaires possibles, correspondant au deux valeurs du nombre
quantique magnétique de spin ms =±½. Cette situation est
idéale pour la spectroscopie RMN. Un moment magnétique de spin peut
être assimilé à une aiguille aimantée microscopique.
En absence de champ magnétique extérieur, son orientation est
quelconque ; cela correspond à un seul niveau d'énergie. En présence
d'un champ magnétique extérieur, cette aiguille peut s'orienter
parallèlement au champ ( situation la plus stable) ou antiparallèlement
au champ. Deux niveaux d'énergie différents correspondent à cette
situation.( levée de dégénerescence ). La spectroscopie RMN consiste à
observer des transitions entre ces deux niveaux d'énergie.
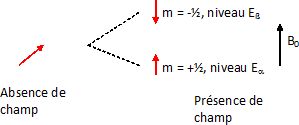
Proton isolé : les noyaux
dans l'état d'énergie Ea
peuvent absorber de l'énergie pour passer dans l'état Eß.
Cette énergie peut être apportée par une onde électromagnétique.
Proton lié une
molécule : le champ magnétique B régnant au niveau du noyau
diffère du champ extérieur B0.
B = B0(1-s).
s : constante
d'écran dépendant uniquement de l'environnemen chimique du noyau étudié.
Le déplacement chimique d = (sR-s)106 ppm est
indépendant de B0, donc du type d'appareil.
sR : déplacement
chimique servant de référence.
Comment
expliquer à un élève de terminale S ce que signifie les lettres m, s et
d ?
s : singulet : l'atome de carbone le plus proche du proton étudié, ne
compte aucun hydrogène ( zéro voisin).
d : doublet : l'atome de carbone le plus
proche du proton étudié, compte un hydrogène ( un voisin).
t : triplet : l'atome
de carbone le plus proche du proton étudié, compte deux hydrogènes (
deux voisins).
m : multiplet, multiplicité du signal.
Expliquer
l'origine de la caractéristique d à un niveau post-bac.
On considère deux protons HA et HB voisins
de déplacements chimiques différents.
Le proton HA, en interaction avec HB ( d'énergie Ea ou Eß) est
soumis au champ magnétique :
B' = B0(1-s) ±BB
avec BB champ local crée par HB. HA
pouvant résonner à deux fréquences différentes, son signal est un
doublet.
|
.
|







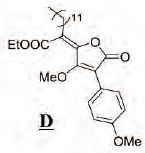
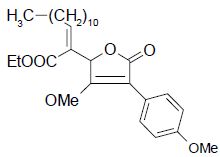 . Pour ce dernier la délocalisation de la double
liaison créée se fait uniquement avec l'ester.
. Pour ce dernier la délocalisation de la double
liaison créée se fait uniquement avec l'ester.