Le
cristal d'oxyde de calcium.
C'est un cristal ionique qui cristallise dans le système de type
chlorure de sodium..
Donner
la structure électronique à l'état fondamental de l'atome de calcium,
après avoir énoncé les règles qui permettent de l'établir.
Règle de Pauli : deux
électrons se différencient par au moins l'un de leur nombres quantiques
n, l, m et s.
Règle de Klechkowski : l'ordre de remplissage des
orbitales se fait suivant (n+l) croissant ; si deux orbitales atomiques
ont le même nombre (l+n), celle qui a la plus faible valeur de n est
remplie en premier ( principe de stabilité)
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f...
Règle de Hund : cas des orbitales de mêmes énergie.
Les électrons de spins parallèles occupent le maximum d'orbitales.
20 Ca : 1s
2 2s
2 2p
6
3s
2 3p
6 4s
2 .
L'atome de
calcium perd facilement deux électrons et donne l'ion Ca2+
dans lequel la couche électronique externe est complète. Le nombre
d'oxydation du calcium dans l'ion calcium est +II, égal à la charge de
l'ion simple.
Représenter
la maille de CaO.
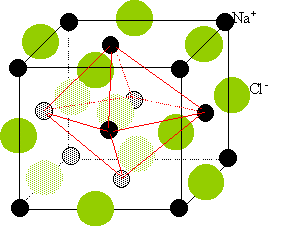
cristaux type
NaCl :
Deux réseaux cubiques à faces centrées, l'un d'ion Na
+,
l'autre d'ion chlorure Cl
-. Ces réseaux se déduisent l'un de
l'autre par translation parallèle aux arètes de la maille et de valeur
égale à la moitié du coté de la maille.
Chaque ion est au centre d'un octaèdre, entouré de 6 ions de signe
opposé occupant les 6 sommets.
Déterminer le nombre
d'ions présents dans la maille CaO. Déterminer le nombre de
motifs par maille.
Chaque ion
situé au sommet du cube est commun à huit mailles, il compte pour
1/8.
Les ions situés sur les huit sommets comptent pour 1/8 *8 = 1.
Chaque ion situé au centre d'une face est commun à 2 mailles : il
compte pour 1/2.
Les 6 ions situés aux centres des 6 faces comptent pour 1/2*6 = 3.
Il y a donc 4 ions calcium et 4 ions oxyde par maille.
Définir
la coordinence.
C'est le nombre d'ions de signe opposé entourant chaque ion, il est ici
de six.
Chaque ion peut être considéré comme étant au centre d'un octaèdre dont
les six sommets sont occupés par des ions de signe opposé.
Etablir
la relation littérale permettant d'accéder à la masse volumique r du cristal CaO.
Calculer sa valeur.
Paramètre de la maille a = 481 pm ; rayon du cation r
+ =99
pm.
La maille compte en propre 4 motifs CaO.
masse de la maille : 4 * masse molaire CaO
(kg/mol)
/ nombre d'Avogadro m = 4 M
NaCl / N
A.
volume de la maille V =a
3. (en m
3)
masse volumique (kg/m
3 ) :
r = m /V=4 M
CaO / (a
3N
A)
r =4*56 10
-3
/ ((481 10
-12)
3 * 6,023 10
23) =3,34 10
3
kg/m
3.