Oxydation du fer
par l'ozone, mesure de pH, décantation, spectrophotométrie, bts
Qiabi 2012.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
Oxydation du
fer par l'ozone.
La
dissolution de l'ozone dans l'eau doit permettre d'éliminer les traces
d'ion fer II afin de la transformer en précipité d'hydroxyde de fer III
Fe(OH)3 (s), qui sera filtré sur bacs à sable.
L'ozone O3 appartient au couple O3 aq / O2
aq de potentiel standard E° = 2,07 V à 298 K.
Ecrire
la demi-équation en milieu acide de ce couple.
O3
aq + 2H+aq + 2e- = O2 aq +H2O(l).
Exprimer son
potentiel de Nernst E. Ce potentiel dépend-il du pH ? Justifier.
E = E°(O3
aq / O2 aq)+0,03 log ([O3
aq][H+aq]2/[O2
aq])
E = 2,07 +0,03 log([O3
aq]/[O2
aq])+0,06
log [H+aq]
E =
2,07 +0,03 log([O3
aq]/[O2
aq])-0,06
pH. Ce potentiel diminue quand le pH augmente.
Faire apparaître les
zones de prédominane de l'oxydant et du réducteur de ce couple sur le
diagramme.
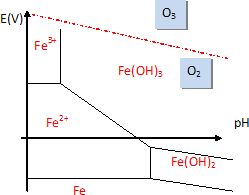
L'ozone peut-il
oxyder les ions Fe2+ ? Justifier.
L'ozone et les ions fer II appartiennent à des domaines disjoints. Le
domaine de l'ozone est situé au dessus du domaine de l'ion fer II.
L'ozone peut donc oxyder cet ion.
Pourquoi
dit-on que l'ozone est un oxydant puissant ?
Le
potentiel standard du couple O3
aq / O2 aq est très élévé. L'ozone est capable d'oxyder un
grand nombre d'espèces chimiques.
Ecrire
la demi-équation électronique en milieu acide pour le couple Fe(OH)3
(s) / Fe2+aq.
2Fe2+aq + 6 H2O(l) = 2Fe(OH)3(s) +2e-
+ 6H+aq.
Ecrire l'équation de
la réaction d'oxydoréduction entre les ions fer II et l'ozone.
Ajouter les deux demi-équations ci dessus.
O3
aq + 2H+aq + 2e- +2Fe2+aq
+ 6 H2O(l) =
O2 aq +H2O(l)+2Fe(OH)3(s)
+2e- + 6H+aq.
Simplifier : O3
aq +2Fe2+aq
+ 5 H2O(l) =
O2 aq + 2Fe(OH)3(s)
+ 4H+aq.
|
| .
. |
|
|
Mesure de pH.
L'eau
doit passer enssuite dans le floculateur où le pH doit être compris
entre 8,4 et 8,9. Un pHmètre comprend une électrode combinée reliée à
un boîtier électronique permettant l'affichage numérique du pH mesuré.
Le potentiel VE de l'électrode combinée d'un pHmètre est une
fonction linéaire du pH de la solution où trempe l'électrode. VE
= -0,06 pH + 0,40 ( volts).
Cette tension est appliquée à l'entrée d'un AO supposé parfait,
fonctionnant en régime linéaire.
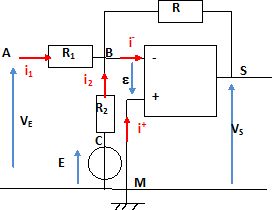
R1 = 1,0 kW ; R =
17 kW ; R2 = 25 kW et E = -10 V.
VS = -R( VE/R1 + E / R2)
Justifier
l'appellation de ce montage " sommateur inverseur".
Ce montage réalise la somme de deux tensions VE R/R1 et E R/ R2 puis il prend l'opposé
de cette somme.
Déterminer VE
et en déduire le pH mesuré. On donne VS
= 6,9 V.
VE = -R1( VS/R
+ E / R2) = -(6,9 / 17 -10 / 25) =-5,88 10-3 V.
VE = -0,06 pH + 0,40 ; pH = (-VE+0,40)
/ 0,06 =6,76 ~6,8.
Quel est l'interêt
de ce montage ?
Ce montage permet d'amplifier le potentiel de l'électrode combiné ; de
plus le potentiel de sortie VS est pratiquement égal au pH
mesuré.
E / R2= -0,4 V ; VE/R1 + E / R2
= -0,06 pH / R1 ; VS = R*0,06 pH / R1 = 17*0,06 pH =
1,02 pH.
Conclure quant à la
qualité de l'eau pour la floculation à suivre.
L'eau est trop acide pour que la floculation soit efficace.
|
.
|
|
Décantation.
L'ajustement
du pH est effectué, la floculation s'opère ce qui permet la
décantation, c'est à dire la chute de grosses particules sous l'action
de la gravité.
On considère un bassin de décantation de section rectangulaire de
longueur l = 10,0 m, de largeur l =4,0 m et de profondeur h = 1,0 m (
hauteur du liquide).
Une suspension contenant des particules de diamètre allant de 1 à 100
µm est alimentée en surface à l'une des extrémité du bassin avec un
débit de Q=5,0 m3/h soit 5 / 3600 =1,4 10-3 m3/s
. Le liquide clarifié ressort par débordement à l'autre extrémité. On
considère l'écoulement de liquide comme étant uniforme sur toute la
section verticale du bassin.
Calculer
la section et le volume du bassin.
Section S = L l = 10,0*4,0 = 40 m2 ; volume V = S h = 40 m3.
Déterminer
la durée t de séjour moyen d'un élément du fluide ( temps de
décantation) dans le bassin et la vitesse horizontale vL d'écoulement du
liquide.
t = V / Q =40 / (1,4 10-3) =2,88 104 s ou 8 h.
VL =L / t =10/ (2,88
104) =3,47 10-4 ~3,5 10-4
m/s.
Calculer la vitesse
de sédimentation limite v S lim.
Il
s'agit de la vitesse verticale que doit avoir une particule pour
qu'elle se retrouve au fond du bassin, à l'aplomb du débordement.
Cette particule aura donc parcouru 10,0 m horizontalement et 1,0 m
verticalement dans la même durée.
10 = v horizontale Dt
; 1,0 = vS lim Dt ; vS
lim= v horizontale
/ 10 = 3,5
10-5 m/s.
En
régime laminaire, la vitesse de sédimentation d'une particule de
diamètre d est donnée par la loi de Stockes : vS =d2(rs-rL)g / (18 hL).
On donne g = 9,81 m s-2 ; rs
= 1700 kg m-3 ; rL
=1000 kg m-3 ; hL
=10-3 Pa s.
Quels paramètres
permettent d'augmenter la vitesse de sédimentation ?
Le diamètre des particules en suspension ainsi que la masse volumique
de ces particules.
Quel
est l'interêt de la floculation ?
La
floculation permet l'agglomération de fines particules en "flocs" de
plus grande taille et de masse volumique plus élevée ; il en résulte
une vitesse de sédimentation plus grande.
Exprimer puis
calculer le diamètre minimal d des particules qui seront sédimentées
dans ce bassin.
Prendre vS lim = 0,125 m h-1 soit 3,47 10-5
m/s.
d2
=18 hL vS
lim / ((rs-rL)g) ;
d = [18 hL vS
lim / ((rs-rL)g)]½
=[18 10-3 *3,47 10-5
/(700*9,81)]½
= 9,5 10-6 m = 9,5 µm.
|
Dosage des
nitrates par spectrophotométrie.
La
norme européenne précise que la teneur de l'eau potable en nitrate ne
doit pas dépasser 50 mg / L. Un technicien effectue le prélevement d'un
échantillon d'eau après traitements. Afin de connaître sa teneur en ion
nitrate, il va réaliser un dosage spectrophotométrique dans le domaine
des rayonnements visibles. Il prépare donc une gamme étalon.
Il prépare la solution mère notée Smère de nitrate de sodium
( NH4NO3) de concentration massique 100 mg/L et
contenant 10 gouttes d'acide 2,4-phénoldisulfonique. La solution a une
coloration jaune.
Il dilue ensuite cette solution afin d'obtenir 4 solutions filles
notées S1, S2, S3 et S4 de
concentrations respectives : 10, 25, 50 et 80 mg/L
Quelle
est la longueur d'onde de travail, parmi les longueurs d'ondes suivantes
? Justifier.
410 nm, 520 nm, 630 nm et 750 nm.
L'oeil
perçoit une teinte jaune ; la solution présente un maximum d'absorption
pour la couleur complémentaire du jaune, c'est à dire le bleu-violet.
La longueur d'onde correspondante est proche de 410 nm.
Après réglage de l'absorbance à zéro pour un échantillon d'eau pure, le
technicien mesure l'absorbance A de chaque échantillon et trace la
courbe d'étalonnage.
Compléter la figure
( axe, courbe) afin de présenter correctement ce graphique.
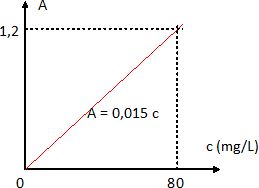
Quelle loi est ainsi
vérifiée ? Ennoncer cette loi en précisant le nom et le symbole des
grandeurs.
La loi de Beer-Lambert : A= elc (
A est l'absorbance ou densité optique).
où e est un
coefficient caractéristique de la substance appelé coefficient
d'absorbance (L
mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L).
Il mesure de même l'absorbance de l'échantillon d'eau prélevé à la
station et trouve A = 0,50.
Déterminer la
concentration en ion nitrate de l'échantillon et conclure.
c = 0,50 / 0,015~33 mg/L, valeur inférieure à la norme 50 mg/L. L'eau
est donc conforme.
|
Chimie organique.
Ecrire la
formule semi-développée du 1,2-dichloropropane.
ClH2C-CHCl-CH3.
Le 1,2-dichloropropane est obtenu par chloration du propane par le
dichlore Cl2 ; il se forme par ailleurs du chlorure
d'hydrogène HCl.
Ecrire
l'équation de cette réaction.
CH3-CH2-CH3 + 2Cl2 -->ClH2C-CHCl-CH3
+ 2HCl.
Donner la
formule semi-développée de tous les isomères du 1,2-dichloropropane
susceptibles de se former et les nommer.
CHCl2-CH2-CH3 :
1,1-dichloropropane ; CH3-CCl2-CH3
: 2,2-dichloropropane ; CH2Cl-CH2-CH2Cl :
1,3-dichloropropane.
L'un de ces isomères a une activité optique. Lequel ? Justifier.
ClH2C-*CHCl-CH3
possède un atome de carbone asymétrique ( repéré par *) : il a une
activité optique.
|


