L'acide tartrique
: solution aqueuse, stéréochimie, loi de Biot, bts Qiabi 2013.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
L’acide
tartrique est utilisé comme additif alimentaire, il est désigné par le
code E334. Il peut jouer le rôle d’antioxydant, de régulateur de pH ou
de séquestrant. Il est autorisé dans la plupart des produits
alimentaires et on le trouve notamment dans les produits à base de
cacao, dans le chocolat, dans les confitures et gelées, dans les fruits
et
légumes en conserves …
L’acide tartrique est issu des déchets de l’industrie vinicole : c’est
en effet le principal acide contenu dans le raisin.
Propriétés
de l’acide tartrique en solution aqueuse.
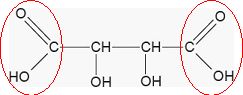
L’acide tartrique est l’acide 2,3-dihydroxybutanedioïque. C’est un
diacide dont la formule semi-développée est représentée ci-dessous. Entourer les
fonctions acide carboxylique.
L’acide tartrique (noté H2T) se comporte comme un diacide en
solution aqueuse et ses pKa ont pour valeur :
pKa1 = 3,04 ; pKa2 =
4,34 (à 25 ° C).
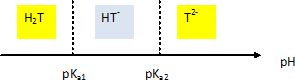
Indiquer,
sur un axe gradué en pH, les zones de prédominance des espèces suivantes
: H2T, HT- et T2-.
Ecrire
les équilibres acido-basiques successifs de dissociation de l’acide
tartrique dans l’eau et donner l’expression des constantes d’équilibre
correspondantes.
H2Taq + H2O(l) = H3O+aq + HT-aq.
Ka1 = [H3O+aq][HT-aq] / [H2Taq].
HT-aq
+ H2O(l)
= H3O+aq + T2-aq. Ka2
= [H3O+aq][ T2-aq] / [ HT-aq].
A partir des valeurs
des pKa, calculer
numériquement les constantes Ka1 et Ka2.
Ka1 = 10-pKa1 = 10-3,04 =9,12 10-4.
Ka2
= 10-pKa2 = 10-4,34 =4,57 10-5.
Pour extraire l’acide tartrique du moût de raisin, on ajoute des ions
calcium Ca2+ : l’acide tartrique réagit avec les ions
calcium Ca2+ pour former du tartrate de calcium, CaT, qui
est un sel peu soluble. L’équation de la réaction ayant lieu est : Ca2+
(aq) + H2T(aq) + 2 H2O(l) =
CaT(s) + 2 H3O+(aq). (1)
Sa constante d’équilibre a pour valeur K = 5,4.10-2 à 25 ° C.
Donner
l’expression de K en fonction des concentrations des espèces à
l’équilibre.
K = [H3O+(aq)]2
/ ([H2T(aq)][Ca2+
(aq)]).
Discuter
qualitativement de l’influence d’une augmentation de la concentration
en ions calcium sur le rendement de l’extraction. Justifier.
A pH constant, une augmentation de la concentration en ion calcium,
déplace l'équilibre (1) dans
le sens direct.
La masse de précipité CaT(s) augmente ainsi que le rendement de
l'extraction.
Discuter
qualitativement de l’influence d’une augmentation du pH de la solution
sur le rendement de l’extraction. Justifier.
Une augmentation du pH ( diminuion de la concentration en ion oxonium
), déplace l'équilibre
(1) dans
le sens direct.
La
masse de précipité CaT(s) augmente ainsi que le rendement de
l'extraction.
|
| .
. |
|
|
Stéréochimie.
On s’intéresse à l’acide (+) tartrique ou (2R,3R) acide
2,3-dihydroxybutanedioïque. Il comporte plusieurs atomes de carbones
asymétriques.
Donner
la définition d’un atome de carbone asymétrique.
Un atome de carbone asymétrique est tétragonal et lié à 4 atomes ou
groupe d'atomes différents.
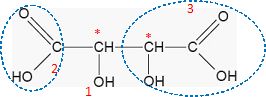
Repérer
chaque atome de carbone asymétrique par un astérisque. Classer les groupes
attachés à chaque carbone asymétrique par ordre de priorité en suivant
les règles de Cahn, Ingold et Prelog.
En
déduire une représentation de Cram du (2R,3R) acide
2,3-dihydroxybutanedioïque. Justifier.
Le (2R,3R) acide 2,3-dihydroxybutanedioïque possède un énantiomère.
Rappeler
ce que sont deux énantiomères.
Deux énantiomères sont deux molécules images l'une de l'autre dans un
miroir plan. Ces deux molécules ne sont pas superposables.
Donner
une représentation de Cram de cet énantiomère.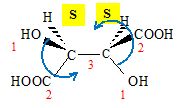
Quelle
propriété permet de distinguer deux énantiomères ?
Deux énantiomères font tourner la lumière polarisée de manière opposée.
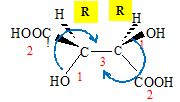
Un stéréoisomère de l’acide tartrique, dont une représentation de Cram
figure ci-dessous, ne présente pas la propriété citée ci-dessus. 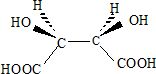
Indiquer
pour quelle raison ce stéréoisomère ne présente pas cette propriété.
Cette molécule possède un plan de symétrie.
Activité
optique.
L’activité optique fut découverte en 1811 par François Arago et Jean
Biot.
L’acide (+)-tartrique présente une activité optique.
La loi de Biot permet de mesurer l’activité optique. Dans le cas
où une seule substance est active, elle peut s’écrire :
a = [a ]20D .L.C
Expliciter
les différents termes intervenant dans cette relation et préciser leur
unité.
a (°) angle de rotation du plan de vibration des
ondes lumineuses ; [a
]20D : pouvoir
rotatoire spécifique ( ° m2 kg-1 ); C:
concentration ( kg m-3 ) ; L: longueur (m) de cuve.
Définir les termes
dextrogyre et lévogyre.
Il existe deux variétés de substances optiquement actives : les
substances lévogyres qui font tourner le plan de polarisation vers la
gauche et les substances dextrogyres qui font tourner ce plan vers la
droite.
L’acide
(+)-tartrique est-il une substance dextrogyre ou lévogyre ? Justifier.
Par convention, une
molécule lévogyre est notée (-), et une molécule dextrogyre est notée
(+). L’acide (+)-tartrique est donc dextrogyre.
Le pouvoir rotatoire spécifique de
l’acide (+)-tartrique est, à la température de 20 ° C :
[a
]20D =+12,5 °.dm-1.g-1.cm3.
|
.
|
|
La
lettre D indique que le pouvoir rotatoire spécifique correspond à des
mesures réalisées avec la raie D du sodium, onde monochromatique de
longueur d’onde l = 589 nm.
Déterminer,
en joule puis en électronvolt, l’énergie E des photons ayant cette
longueur d’onde.
h = 6,63 10-34 Js ; c = 3,00 108 m/s ; e = 1,60 10-19
C.
E = hc/l =
6,63 10-34 *
3,00 108/
(589 10-9) = 3,38 10-19 J ou 3,38
10-19 /(1,60
10-19)=2,11 eV.
Un
diagramme énergétique simplifié des niveaux d’énergie de l’atome de
sodium est représenté.
Légender
ce diagramme en repérant le niveau fondamental et les niveaux excités.

Quelle
énergie minimale faut-il fournir à l’atome de sodium dans son état
fondamental pour obtenir l’ion Na+ ? 5,14 eV.
Déterminer
la transition à laquelle correspond l’émission d’un photon de longueur
d’onde l = 589 nm.
5,14 -3,03 = 2,11 eV, transition du niveau n=2 vers le niveau n=1.
Le spectre
visible du sodium comporte deux autres raies à 567 et 615 nm. La
lumière émise par une lampe à vapeur de sodium est donc polychromatique.
Indiquer
comment il est possible, à partir d’une lampe à vapeur de sodium,
d’obtenir une lumière monochromatique de longueur d’onde l = 589 nm.
Le faisceau lumineux polychromatique issu de la source traverse une
fente d'entrée située au point focal d'un miroir sphérique : tous les
rayons réfléchis par le miroir sont parallèles.
Le faisceau parallèle polychromatique est diffracté par un
réseau,
puis est collecté par un autre miroir qui le focalise sur la fente de
sortie. Les différentes longueurs d'onde sont séparées au niveau de la
fente de sortie chacune arrivant à un point différent de la fente.
Un technicien prépare une solution aqueuse d’acide (+)-tartrique à 1,0
mol.L-1. Il souhaite contrôler la concentation de la
solution préparée, en utilisant la polarimétrie.
Après avoir traversé 30,0 cm de cette solution d’acide (+)-tartrique,
l’analyseur d’un polarimètre doit être tourné de +5,5 degrés pour
rétablir l’équipénombre (à 20 ° C).
En
utilisant la loi de Biot, déterminer la concentration massique en acide
(+)-tartrique de la solution.
C
= a
/( [a ]20D
.L) =5,5 /(12,5 *3,0) =0,147 g cm-3.
En
déduire sa concentration molaire en mol.L-1.
Masse molaire de l'acide tartrique : M =4*12+6+16*6=150 g/mol.
0,147/150 = 9,8 10-4 mol cm-3 = 0,98 mol /L.
La
concentration déterminée par la loi de Biot est-elle en accord avec la
concentration attendue ?
A 2 % près les deux valeurs de la concentration sont en accord.
|
Rôle de conservateur.
Un séquestrant est un additif alimentaire dont le rôle est d’améliorer la qualité et la stabilité des produits alimentaires.
Les séquestrants sont, au sens chimique, des ligands qui forment des
complexes chimiques avec des ions métalliques tels que le cuivre, le
fer et le nickel, qui sont des catalyseurs de l’oxydation des matières
grasses. Les séquestrants limitent donc la disponibilité de ces cations
et agissent ainsi comme des agents conservateurs.
La liqueur de Fehling contient un complexe qui se forme en milieu basique lors de la réaction entre les ions cuivrique Cu2+ et les ions tartrate T2-. Les ions tartrate permettent la stabilisation des ions cuivrique en milieu basique.
A partir de quel pH les ions tartrate prédominent-ils devant H2T et HT- ?
A partir de pH = pKa2 +1 = 5,4 les ions tartrate prédominent devant H2T et HT-.
L’ion complexe présent dans la liqueur de Fehling a pour formule [CuT2]2-. Sa structure est plan carré.
Ecrire l’équation de sa réaction de formation en milieu basique.
Cu2+ aq + 2T2-aq = [CuT2]2-aq.
Le test à la liqueur de Fehling permet de caractériser les sucres (ou
oses) réducteurs : en milieu basique, à chaud et en présence d’un sucre
réducteur, les ions cuivrique complexés réagissent pour donner un
précipité rouge brique d’oxyde cuivreux Cu2O(s). L’équation de cette réaction est :
2CuT2]2-aq +RCHO + 5HO-aq = Cu2O(s) + RCOO-aq + 4T2-aq + 3 H2O(l).
Rappeler le nom de la fonction présente dans les sucres réducteurs qui réagit avec les ions cuivrique complexés.
La fonction aldehyde réagit avec la liqueur de Fehling.
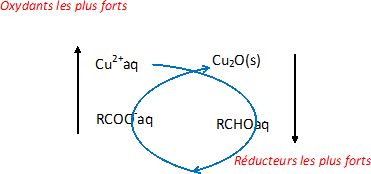
Ecrire les deux couples mis en jeu dans cette réaction et identifier l’oxydant et le réducteur de chaque couple.
Dans chaque couple l'oxydant est écrit en premier.
RCOO-aq / RCHO ; Cu2+aq / Cu2O(s).
La réaction observée lors du test étant spontanée, placer qualitativement ces couples sur l’axe des potentiels standards.
L'oxydant le plus fort réagit spontanément avec le réducteur le plus fort.
|
|