Microscope, spectrophotométrie,
thermochimie. Bts bioanalyse et contrôles 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
Observation au
microscope.
On
se propose d'observer une spore de Penicillium Camemberti à l'aide d'un
microscope dont les caractéristiques sont : objectif, lentille L1
de centre optique O1 et de distance focale f ' 1
= 4,0 mm ; oculaire, lentille L2 de centre
optique O2 et de distance focale f ' 2 = 2,0 cm ;
intervalle optique D = F'1F2
= 16,0 cm ; distance minimale de vision distincte : dm = 25
cm ; Grossissement commercial du microscope G = Ddm/(f '1 f '2)
= a'/a.
Pouvoir de résolution de l'oeil qm
= 3 10-4 rad.
Le spore à observer sera noté AB.
Quelle doit être la
position de l'image intermédiaire A1B1, de
l'objet AB, donnée par L1, pour qu'un observateur puisse
observer l'image définitive A'B' à l'infini ?
L'image intermédiaire doit se trouver au foyer objet de l'oculaire.
Quelle
est la nature de l'image intermédiaire ? Préciser ses caractéristiques.
L'image
intermédiaire est à droite de L1, donc réelle, inversée par
rapport à l'objet, plus grande que l'objet.
Faire
un schéma clair du microscope sans souci d'échelle.
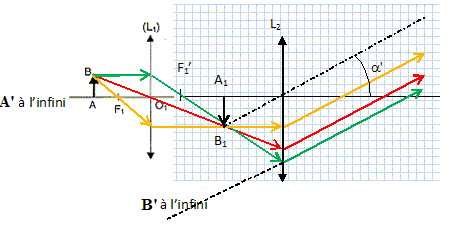 Calculer la valeur
du grossissement G.
Calculer la valeur
du grossissement G.
G = Ddm/(f '1 f '2)
=0,160 *0,25 / (0,004*0,02) =500.
Calculer l'angle a sous lequel l'oeil voir à l'oeil
nu une spore située à 25 cm de l'oeil.
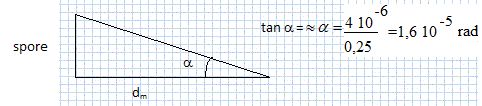 Calculer a' .
Calculer a' .
a' = G a = 500 *1,6 10-5 =8,0
10-3 rad.
Comparer
a' et a au pouvoir de résolution de
l'oeil et conclure.
a est inférieur
au pouvoir de résolution de l'oeil : la spore n'est pas visible à
l'oeil nu.
a' est supérieur
au pouvoir de résolution de l'oeil : la spore peut être observée à
l'aide d'un microsocpe.
Le pouvoir de résolution d'un microscope est limité par la diffraction.
La dimension AB mini du plus petit objet observable est
donnée par : AB mini = 1,22 l / (2 n sin u).
l : longueur d'onde de la radiation utilisée ; n sin u : ouverture
numérique de l'objectif.
Calculer
AB mini si l = 550 nm et u =
60 °. n air = 1,0.
AB mini = 1,22 *550 10 -9 / (2*1,0 sin 60 ) =3,87
10 -7 m ~3,9 10 -7 m.
La spore ayant
une dimension de l'ordre de 4 µm, valeur supérieure à ABmini,
peut donc être observée au microscope.
u
et l étant constantes,
justifier l'utilisation d'un bain d'huile pour améliorer le pouvoir
séparateur.
L'indice de réfraction de l'huile est supérieur à celui de l'air.
|
| .
. |
|
|
Spectrophotométrie.
On
se propose de contrôler par spectrophotométrie la concentration en
permanganate de potassium d'une solution commerciale de liqueur de
Dakin ouverte depuis plusieurs semaines. Le spectrophotomètre comporte
une source de lumière polychromatique et un réseau possédant 8 105
traits par mètre. Il est muni d'une cuve de longueur l=1 cm.
Donner l'expression
de la loi de Beer-Lambert et
expliciter chaque grandeur.
La loi de Berr-Lambert
exprime la variation de l'intensité lumineuse en fonction de la
distance parcourue dans un milieu transparent. Lorsqu'une lumière
monochromatique d'intensité I0 traverse un milieu homogène,
l'intensité de la lumière émergente I décroît exponentiellement lorsque
l'épaisseur l du milieu absorbant augmente.
I = I0 . e (- al)
a est une constante appelée coefficient d'absorption,
caractéristique du milieu et de la longueur d'onde considérés.
Dans le cas des solutions, la loi de Beer fait intervenir les
concentrations.
I = I0 . e (- elc)
où e est
un coefficient caractéristique de la substance appelé coefficient
d'absorbance ( m2 mol-1), l est
l'épaisseur de la cuve (m) et c la
concentration de la solution (mol m-3).
Cette loi est vérifiée lorsque la solution est de concentration
inférieure à : c < 0,1 mol.L-1.
La relation fondamentale utilisée en spectrophotométrie est présentée
sous la forme :
A= log (I0/I) = elc ( A est l'absorbance
ou densité optique)
e
est une caractéristique de la molécule. Plus e sera grand, plus la
solution absorbe.
Indiquer le rôle du
réseau.
Le
réseau diffracte la lumière polychromatique de la source et permet de
sélectionner la longueur d'onde de la lumière qui traverse la solution
étudiée.
Justifier le choix
de l = 525 nm.
Pour une meilleur précision la longueur d'onde de travail doit
correspondre au maximum d'absorption de la solution. La solution de
permanganate est violette. L'absorption est maximum pour la couleur
complémentaire du violet, c'est à dire le vert jaune ( l = 525 nm).
La mesure de l'absorbance est A = 0,103. En déduire la
concentration en permanganate de potassium.
e = 225 mol-1m2
; l = 0,010 m ; c =
A /(el) =0,103 / (225 *0,010)
=0,0458 mol m-3 ou 4,58 10-5 mol/L.
Montrer
que la concentration massique en permanganate de potassium est 7,24 mg/L.
M(KMnO4 ) = 158 g/mol. Cm = c M(KMnO4
) =4,58 10-5 *158 =7,23 10-3
g/L ou 7,23 mg/L.
Calculer
l'écart relatif entre Cm et celle
attendue 10 mg/L.Conclure.
(10-7,23) / 10 ~28 %. L'eau de Dakin doit être conservée à l'abri de la
lumière sinon elle se décompose rapidement en quelques jours.
|
.
|
|
| Synthèse de l'ammoniac .
Données à 298
K ; R= 8,31 J K-1 mol-1. Les gaz sonr
assimilés à des gaz parfaits.
On donne les enthalpies standard de
formation et les entropies standard de certains
composés chimiques.
|
Composé
|
N2 gaz
|
H2 gaz
|
NH3 gaz
|
|
DfH°
(kJ/ mol)
|
0
|
0
|
-46,19
|
|
S° (J mol-1
K-1)
|
191,5
|
130,6
|
192,5
|
pKa(NH4+/NH3)=9,2
; produit ionique de l'eau Ke =
10-14.
Calculer l'enthalpie standart
DrH°
de la réaction de synthèse de l'ammoniac
à 298 K.
N2(g) + 3 H2(g) =
2NH3(g)
DrH°
=2DfH°
(NH3(g)) - 3DfH°
(H2(g))-DfH°
(N2(g)) = 2*(-46,19) =
-92,38 kJ.
La réaction est-elle
exothermique, endothermique, athermique ?
Justifier.
DrH°
< 0, la réaction est
exothermique.
Calculer l'entropis standard de
cette réaction à 298 K.
DrS°
=2S° (NH3(g)) - 3S°
(H2(g))-S° (N2(g)) =
2*192,5-3*130,6-191,5 =
-198,3 J
K-1.
Initialement il y a 4 molécules, à la fin il n'y en a plus que 2 : l'ordre augmente ; l'entropie sera donc négative.
Montrer que l'enthalpie standard DrG°
associée à cette réaction
à 298 K vaut -3,329 104 J mol-1.
DG° = DH°-TDS° = -92,38 103 -298*(-198,3) =-3,329 104 J mol-1.
DrG°
<0, cette réaction est
thermodynamiquement
possible.
Calculer la
constante d'équilibre de la réaction
à 298
K.
DrG°
= -RT ln K
ln K =-(-33,29 103 )/ (8,31*298)
=13,44 ; K =
6,86 105.
K est très grand, la réaction dans le sens direct est totale.
Quel est l'influence
sur l'équilibre de la
réaction
- d'une augmentation de pression à température constante ?
Lors d'une hausse de pression à
température constante et en système
fermé, l'équilibre est
déplacé dans le direct, c'est
à dire diminution du nombre de moles de
gaz.
- d'une augmentation de
température à pression constante ?
Justifier.
Toute hausse de température
appliquée à un système
fermé en équilibre, maintenu à
pression ou encore à volume constant
entraîne un déplacement dans le sens
indirect , si la réaction exothermique.
Expliquer le choix d'une température de 450 °C pour effectuer la synthèse de l'ammoniac.
La température est un facteur cinétique. Une température trop élévée favorise l'évolution de l'équilibre dans le sens indirect.
|
|
|