Entretien des
objets argentés, synthèse du styrène : bts
Bioanalyse et contrôle 2013.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
Entretien des
objets argentés.
Les objets argentés se dégradent au fil du temps du fait de
l'apparition d'un film noir de sulfure d'argent Ag2S. La
formation de ce solide résulte de l'action conjuguée du dioxygène
atmosphérique et du sulfure d'hydrogène ( présent dans l'atmosphère,
issu de l'alimentation ou issu des protéines de notre organisme ). Le
processus répond à l'équation de réaction suivante :
4Ag(s) + O2(g) +2H2S aq ---> 2Ag2S(s)
+2H2O(l).
Cet exercice propose dans un premier temps l'explication de la
formation du film noir de sulfure d'argent sur un couvert argenté.
Dans un deuxième temps sera abordé une technique visant à régénérer
l'argent métallique par élimination du dépôt noir de sulfure d'argent
afin de redonner au couvert d'argent son éclat originel.
Formation
du film de sulfure d'argent.
En absence d'ion sulfure S2-, le potentiel standard du
couple Ag+/Ag(s) vaut E1°=+0,80 V. En présence
d'ion sulfure ( issu de H2S), l'argent métallique devient
très sensible à l'oxydation, comme en témoigne la valeur du potentiel
standard E2° du couple Ag2S(s) / Ag(s) : E2°
=-0,69 V.
Nous allons mettre en évidence de façon qualitative l'évolution du
potentiel d'oxydoréduction E(Ag+/Ag(s)).
Ecrire la
demi-équation du couple Ag+/Ag.
Ag+aq + e-
= Ag(s).
En déduire
l'expression littérale du potentiel d'oxydoréduction de ce couple.
E(Ag+/Ag) = E°(Ag+/Ag) +
0,06 log [Ag+].
En présence d'ion sulfure, les aions argent conduisent à la formation
d'un précipité de sulfure d'argent
Ecrire
l'équation de la réaction de précipitation.
2Ag+aq + S2-aq ---> Ag2S(s).
Expliquer sans
calcul, pourquoi le potentiel d'oxydoréduction E(Ag+/Ag)
diminue lorsque des
ions sulfure sont présents dans le milieu.
La concentration des ion Ag+ aq diminue du fait de la
réaction de précipitation.
log
[Ag+] diminue donc et en conséquence E(Ag+/Ag)
décroît.
Expliquer alors
succinctement pourquoi l'oxydation de l'argent métallique Ag par le
dioxygène de l'air est beaucoup plus facile en présence d'ion sulfure.
On précise que dans ces conditions : E(O2(g)/ H2O(l))
> E(Ag+/Ag(s)) > E(Ag2S(s)/Ag(s)).
La différence des potentiels d'oxydoréduction E(O2(g)/
H2O(l)) - E(Ag+/Ag(s)) est voisine de 1,26-0,8
=0,46 V en absence d'ion sulfure.
La
différence des potentiels d'oxydoréduction E(O2(g)/
H2O(l)) - E(Ag2S(s)/Ag(s)) est
voisine de 1,26-(-0,69)= 1,95 V en présence d'ion sulfure.
Plus la différence entre les potentiesl d'oxydoréduction est grande,
plus la réaction est facile.
|
| .
. |
|
|
Entretien d'un
couvert d'argent terni.
Au fond d'un cristallisoir rempli d'eau salée, on dispose d'une feuille
de papier aluminium Al(s). On y plonge l'objet argenté terni par la
couche noir de sulfure d'argent, en assurant un contact entre
l'aluminium et l'objet. Aprés quelques minutes, on observe la réduction
du sulfure d'argent en argent métallique : l'objet a retrouvé son
éclat. Une odeur désagréable d'oeuf pourri émane du cristallisoir au
fur et à mesure de la disparition du sulfure d'argent.
Montrer
que l'équation de la réaction d'oxydoréduction mise en jeu lors du
processus s'écrit :
3Ag2S(s) +2Al(s)
+6H+aq = 6Ag(s) +2Al3+aq + 3H2S(g).
On donne E°(Ag2S(s) / Ag(s)) =-0,69 V ; E°(Al3+aq)
Al(s)) =-1,68 V à 25°C.
Al(s) est le réducteur le plus fort, il s'oxyde : 2 fois {Al(s) = Al3+aq +3e-}.
Ag2S(s) est
l'oxydant le plus fort, il se réduit : 3 fois {Ag2S(s)+2H+aq
+2e- = 2Ag+ +H2S(g)}.
Ajouter : 2Al(s) +3Ag2S(s)+6H+aq
+6e-= 2Al3+aq +6e-+6Ag+ +3H2S(g).
Simplifier : 2Al(s)
+3Ag2S(s)+6H+aq
= 2Al3+aq +6Ag+ +3H2S(g).
(1)
Donner l'expression
littérale de la force électromotrice standard DE° de la pile ainsi
formée et calculer sa valeur.
DE° = E°(Ag2S(s)
/ Ag(s))-E°(Al3+aq)
Al(s)) = -0,69 -(-1,68) = +0,99 V.
Expliquer
le caractère spontané de cette réaction dans les conditions standards.
DE° étant très grande, la
constante d'équilibre de la réaction (1) est importante et cet
équilibre est largement déplacé dans le sens direct, réduction de Ag2S(s).
Justifier
l'odeur désagréable qui s'échappe du milieu réactionnel.
Il se forme du sulfure d'hydrogène gazeux H2S, gaz ayant une
odeur d'oeuf pourri.
Préciser
pourquoi il est nécesaire d'utiliser de l'eau salée plutôt que de l'eau
distillée pour réaliser cette expérience.
Du fait de la présence d'ion sodium Na+aq et chlorure Cl-aq,
l'eau salée conduit mieux le courant électrique que l'eau distillée.
|
.
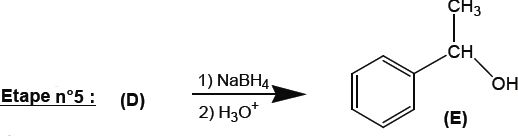
On réalise le spectre IR du composé obtenu à l'issue de cette étape.
Indiquer comment on peut vérifier que l'on a bien formé le composé E et qu'il ne reste plus de réactif D.
Disparition de la bande due à l'élongation de la liaison C=O des cétones vers 1700 cm-1.
Apparition de la bande large, forte due à l'élongation de la liaison O-H ( alcool lié ) entre 3200 et 3600 cm-1.
Nommer la molécule E suivant la nomenclature officielle.
1-phényléthan-1-ol.
La molécule E peut exister sous forme de deux énantiomères.
Représenter l'énantiomère de configuration absolue R en justifiant.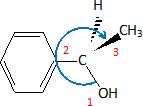
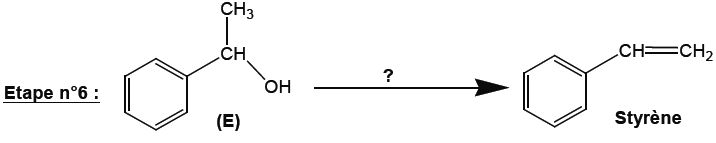
Préciser les conditions opératoires permettant de passer de la molécule E au styrène. Indiquer le type de réaction mis en jeu.
Elimination d'une molécule d'eau ( déshydratation) d'un alcool.
Léger chauffage en présence d'acide phosphorique dilué.
|
|