Chimie organique ; autour de l'ion
cyanure. Bts Biotechnologies 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
Chimie organique.
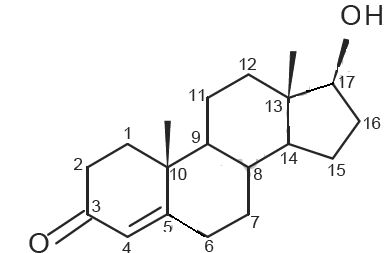
La molécule de testostérone contient 6 atomes de carbone
asymétriques.
 Qu'est-ce
qu'un atome de carbone asymétrique ?
Un atome de
carbone asymétrique est tétragonal, relié à 4 atomes ou groupes
d'atomes différents.
Qu'est-ce
qu'un atome de carbone asymétrique ?
Un atome de
carbone asymétrique est tétragonal, relié à 4 atomes ou groupes
d'atomes différents.
Donner les numéros
des six atomes de carbone asymétrique de cette molécule.
n°8, 9, 10, 13, 14 et 17.
Donner le nombre
maximal de stéréoisomères d'une molécule comportant six atomes de
carbone asymétriques.
26 =64.
Dans le cas de la lutte contre le dopage, on dose le rapport
testostérone / épitestostérone. Ces deux molécules diffèrent entre
elles par la seule configuration du carbone n°17.
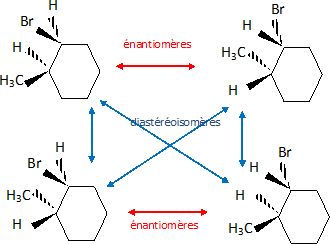
Ces
molécules sont-elles énantiomères ? Justifier.
Le carbone n°17 est asymétrique ; tous les autres atomes de carbone de
ces deux molécules ont la même configuration. Testostérone et épitestostérone
sont donc diastéréoisomères.
Voir dans le cas de deux atomes de carbone asymétriques :
Synthèse de l'éthylbenzène.
Ecrire la formule
semi-développée de l'éthanal. A quelle famille de composé l'éthanal
appartient-il ?
L'éthanal CH3-CHO est un aldehyde.
A partir de l'éthanal, on peut obtenir un acide carboxylique comportant
le même nombre d'atomes de carbone.
Donner
le type de réaction. Donner le nom et la formule semi-développée de cet
acide A.
L'oxydation ménagée de l'éthanal conduit à l'acide éthanoïque CH3-COOH.
Par action d'un agent chlorurant sur A on fabrique le chlorure
d'éthanoyle B.
Ecrire
la formule semi-développée de B et citer un agent chlorurant.
CH3-COCl ; agent chlorurant PCl5.
On réalise ensuite
l'acylation du benzène par le composé B, on obtient le composé C.
De
quel type de réaction s'agit-il ? Quel catalyseur peut-on utiliser ?
Ecrire l'équation de la réaction.
Substitution électrophile sur le noyau benzénique en présence de
chlorure d'aluminium AlCl3.
C6H6 +CH3-COCl ---> C6H5-CO-CH3
+ HCl.
Le mécanisme réactionnel fait intervenir un ion qui attaque le cycle
benzénique.
Ecrire la formule semi-développée de cet ion.
Cation acylium 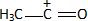 . .
Quelle
est la fonction chimique caractéristique du composé C ?
C est une cétone.
Une réduction de Clemmensen conduit à l'éthylbenzène D.
Ecrire
la formule semi-développée de D. C6H5-CH2-CH3.
|
| .
. |
|
|
L'ion cyanure.
Cet ion CN- est la base conjuguée de l'acide cyanhydrique
HCN. Le pKa de ce couple vaut 9,3.
Donner
le schéma de Lewis de la molécule d'acide cyanhydrique.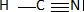
l'ion cyanure est utilisé dans le procédé de lixiviation de l'or, qui
permet sa récupération par mise en oeuvre d'une solution aqueuse de
cyanure de sodium. Pour éviter tout dégagement toxique, le pH est
maintenu à 10,5.
Calculer le rapport [HCNaq] / [CN-aq] et commenter.
pH = pKa + log ( [CN-aq]/[HCNaq]) ; log ( [CN-aq]/[HCNaq]) = 10,5-9,3 =1,2.
[CN-aq]/[HCNaq] ~16 ; [HCNaq] / [CN-aq] = 0,063.
A pH = 10,5, il reste 6 % de HCN ; le dégagement de gaz toxique n'est
pas négligeable.
La destruction des ions cyanure fait intervenir leur oxydation en ion
cyanate CNO-.
Ecrire
la demi-équation électronique correspondant à cette oxydation en milieu
acide.
CN-aq + H2O ---> CNO- aq +2H+aq+2e-.
En
faisant intervenir les ions hydroxyde, établir cette demi-équation en
milieu basique.
CN-aq + 2HO-aq ---> CNO-
aq +H2O+2e-.
|
.
|
|
Deux
ions cyanure jouant le rôle de ligands autour de l'ion argent I peuvent
former un complexe, l'ion dicyanoargentate I.
Ecrire
l'équation chimique de la réaction de formation de ce complexe.
2CN-aq + Ag+ aq ---> [Ag(CN)2]-aq.
Exprimer la
constante de formation de ce complexe.
Kf = [[Ag(CN)2]-aq] / ([CN-aq]2[Ag+ aq]).
Dans une solution aqueuse de nitrate d'argent de concentration C1
= 1,0 10-2 mol/L on ajoute sans variation de volume des ions
cyanure. La concentration initiale des ions cyanure est [CN- aq]0=3,0
10-2 mol/L.
Une électrode d'argent plongée dans la solution a pour potentiel redox
E= -0,28 V.
Ecrire
la demi-équation électronique associée au couple Ag+aq /
Ag(s).
Ag+aq + e- = Ag(s).
Montrer que la
concentration molaire de l'ion argent à l'équilibre vaut 1,0 10-18
mol/L.
E = E°(Ag+aq /
Ag(s)) +0,06 log [Ag+aq]éq.
-0,28 = 0,80 + 0,06 log [Ag+aq]éq ; log [Ag+aq]éq
= -1,08 / 0,06 = -18 ; [Ag+aq]éq
=1,0 10-18 mol/L.
Calculer
la concentration à l'équilibre des ions complexes formés et des ions
cyanures restants. Ce tableau est dressé pour un volume de
solution égal à 1 L.
Etat
|
Avancement
(mol)
|
Ag+ aq |
+2CN-aq |
--> [Ag(CN)2]-aq |
initial
|
0
|
1,0
10-2
|
3,0
10-2 |
0
|
à
l'équilibre
|
x~1,0
10-2
|
1,0
10-2 -x = 1,0 10-18
|
3,0
10-2 -2x =1,0 10-2 |
x=1,0
10-2 |
En déduire la valeur
de KF.
Kf =1,0 10-2 / ( (1,0 10-2)2*
1,0 10-18) =1,0 1020.
|
|
|