Synthèse de
l'Inapétyl : bts Biotechnologie 2013.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
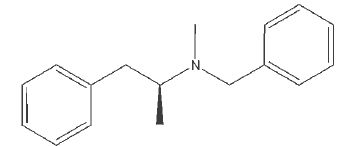
L'inapétyl,
noté H, est le nom commercial de la
(2S)-N-benzyl-N-méthyl-1-phénylpropan-2-amine, dérivé de l'amphétamine,
utilisé pour restreindre l'appétit chez les personnes souffrant
d'obésité. Sa formule est la suivante :
 Une synthèse de la molécule est proposée ci-dessous :
Une synthèse de la molécule est proposée ci-dessous :
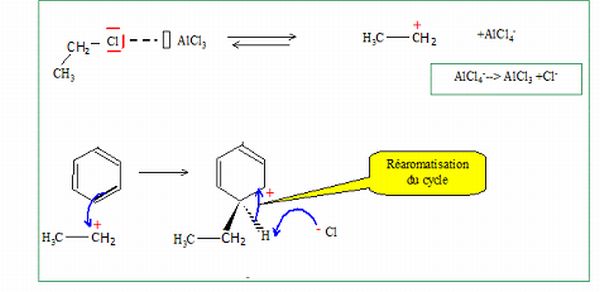
Etape 1 :
le benzène réagit avec le monochloroéthane en présence de trichlorure
d'aluminium AlCl3 pour former un composé A monosubstitué.
Ecrire l'équation de la réaction.
C6H6 + CH3-CH2Cl ---> C6H5-CH2-CH3 + HCl.
Donner le mécanisme de cette réaction en explicitant le rôle de AlCl3.
AlCl3 ( acide de Lewis ) est un catalyseur, il conduit à la formation d'un carbocation.
Etape 2 : le composé A traité par le dichlore en présence d'UV est transformé en un produit monohalogéné B
C6H5-CH2-CH2Cl.
Ecrire l'équation de la réaction et caractériser cette réaction à l'aide d'un ou plusieurs des mots suivants : addition, substitution, élimination, radicalaire, électrophile, nucléophile
C6H5-CH2-CH3 + Cl2 ---> C6H5-CH2-CH2Cl + HCl.
Substitution radicalaire sur la chaîne latérale.
|
| .
. |
|
|
Etape 3 : en présence de magnésium solide dans l'éther anhydre, le composé B réagit pour donner un produit C.
Ecrire la formule semi-développée du composé C.
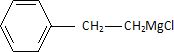
Citer au moins une des précautions à prendre au cours de cette synthèse.
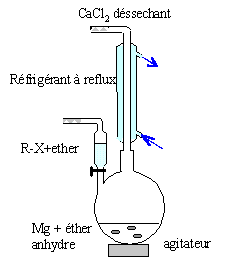 |
lI faut travailler en milieu anhydre, sinon l'organomagnésien est
détruit par l'eau ( la réaction est vive); de plus l'éther, par ses
propriétés basiques, stabilise l'organomagnésien formé.
L'éther est un produit inflammable : travailler en absence de flamme. |
|
.
Etape 7 :
le composé F est traité par du dihydrogène sur le nickel de Raney. On
observe une hydrogénation de la double liaison C=N. On obtient une
amine secondaire notée G de formule brute C10H15N.
Ecrire la formule semi-développée du composé G.

Etape 8 : le composé G réagit avec le 1-chloro-1-phénylméthane en présene d'une base pour donner H.
Caractériser la réaction à l'aide d'un ou plusieurs des mots suivants : addition, substitution, élimination, radicalaire, électrophile, nucléophile.
Alkylation de l'amine par substitution nucléophile.
La vitesse de la réaction de l'étape 8 ne dépend pas de la concentration du composé G.
Quelle précision d'ordre cinétique peut-on apporter sur la nature du mécanisme ?
SN1 : la première étape ( formation du carbocation C6H5-CH2+ ) est cinétiquement déterminante.
|
|