Comment restaurer
un canon ancien : bac
S Amérique du Sud 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Après
des siècles d’immersion dans l’eau de mer, les canons se recouvrent de
concrétions marines formant une carapace très dure de quelques
centimètres d’épaisseur appelée la « gangue ». Pour restaurer un canon
ancien, une entreprise spécialisée réalise la première étape du
traitement, une électrolyse d’environ 700 heures, en imposant un
courant électrique constant de 7,5 ampères. Le canon, plongé dans un
grand bain d’eau salée, constitue la cathode de l’électolyseur : il
apparaît à sa surface un dégagement de gaz qui comprime la gangue, et
il devient progressivement possible de séparer celle-ci de la surface
du canon. Le fait de restaurer le canon en retirant la gangue a pour
conséquence de le rendre de nouveau sensible à la corrosion.
Principe de l'électrolyse.
L'électrolyse est un processus au cours duquel de l'énergie électrique
est convertie en énergie chimique. Les deux électrodes (conductrices),
plongées dans une solution appelée électrolyte, sont reliées aux bornes
d’un générateur de courant électrique. La cathode est l’électrode
reliée au pôle négatif du générateur, et l’anode l’électrode reliée au
pôle positif du générateur.
L’intensité I du courant électrique peut s’exprimer en fonction de la charge électrique Q qui traverse le circuit
pendant une durée Dt :
Q = I Dt.
Dans le système international, I s’exprime en ampère (A), Q en coulomb (C) et Dt en seconde (s).
Une mole d’électrons possède une charge électrique q = 9,65×104 C.
D’après : http://www.lenntech.fr/electrolyse.htm
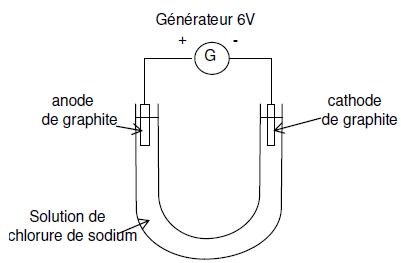
Electrolyse d’une solution de chlorure de sodium au laboratoire.
On réalise le montage ci-dessous :
- dès que le courant passe, on observe un dégagement gazeux aux deux électrodes ;
- après quelques minutes, on ajoute quelques gouttes de phénolphtaléine à la cathode : elle devient rose ;
- de même, quand on ajoute une goutte d’indigo dans le compartiment anodique, on observe qu’il se décolore.
|
| .
. |
|
|
Données :
- L’eau salée contient des ions sodium Na+ et des ions chlorure Cl −.
- Les ions sodium ne réagissent ni à la cathode ni à l’anode.
- Le volume molaire (volume d’une mole de gaz) est de Vm = 24,0 L.mol−1 dans les conditions de l’électrolyse.
- La demi-équation électronique du couple H2O / H2 est : 2 H2O + 2 e−= H2 + 2 HO−.
- Les ions hydroxyde HO− sont corrosifs.
- La phénolphtaléine est incolore pour un pH < 8,2 ; elle est rose pour un pH > 10.
- Une solution aqueuse de dichlore décolore l’indigo.
- On admet qu’au niveau de chaque électrode il ne se produit qu’une seule réaction chimique en même temps.
|
.
|
|
À
partir des documents fournis et de vos connaissances personnelles,
produire un « rapport de sécurité » afin d’attirer l’attention du chef
d’entreprise de l’usine de restauration sur les risques encourus. Le
rapport devra
décrire et expliquer en une dizaine de lignes environ et à l’aide d’un
schéma, le dispositif permettant de réaliser la restauration du canon
en justifiant vos arguments. Vous déterminerez le volume d’un gaz dégagé au cours de cette restauration.
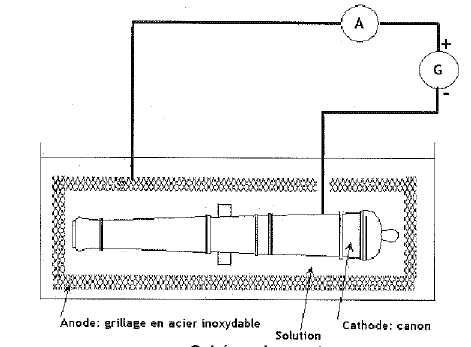
Le canon est la cathode de l'électrolyseur : une réduction se produit à la cathode.
La réaction ayant lieu à la cathode est 2H+aq + 2e- = H2(g). La phénolphtaléine devient rose.
Un oxydation se déroule à l'anode : 2 Cl-aq = Cl2(g) + 2e-. Décoloration de l'indigo.
Relation entre la quantité de matière n(H2) de dihydrogène dégagé est la quantité d'électrons échangés n(e-).
n(e-) = 2n(H2).
Relation entre la valeur absolue de la charge électrique Q,
l'intensité du courant I et la durée de l'électrolyse Dt :
Q = I Dt.
Relation entre la valeur absolue de la charge électrique Q, n(e-), NA et e : Q = n(e-) NA e =n(e-) / (9,65 104).
Relation entre n(H2), I, Dt, NA et e :
2n(H2) NA e = I Dt ; n(H2) = ½ I Dt / (NA e).
Calcul de n(H2) :
n(H2) = 0,5 *7,50 *700 *3600 / 9,65 104 =98,11 ~98,1 mol.
Volume de H2(g) correspondante.
V = n(H2) Vm =98,11 *24,0 = 2,35 103 L.
Le volume de dichlore est également égal à 2,35 103 L.
La solution devient basique et corrosive. Il faudra donc porter des gants et des lunettes de protection.
Le dihydrogène constitue avec le dioxygène de l'air un mélange détonnant : éviter toute flamme et ventiler le local.
Le dichlore se dissout en partie dans l'eau. Le dichlore est
toxique. Il faudra donc prévoir un dispositif pour recueillir ce gaz.
En retirant la gangue le canon devient sensible à la corrosion : il faudra le protéger d'une oxydation par l'oxygène de l'air.
|
|