Les dangers de
l'alcool : IR, RMN, dosage : bac
S Amérique du Sud 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
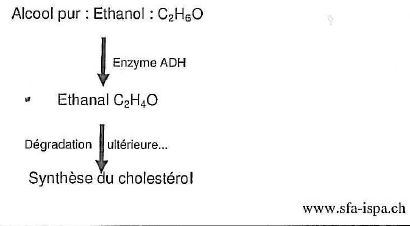
On
trouve dans un document publié par l'institut suisse de prévention de
l'alcoolisme ( ISPA) les informations suivantes : Quand une personne
onsomme de l'alcool, celui-ci commence immédiatement à passer dans le
sang. Plus le passage de l'alcool dans le sang est rapide, plus le taux
d'alcool dans le sang augmentera rapidement, et plus vite on sera ivre.
L'alcool est éliminé en majeur partie par le foie. Dans le foie,
l'alcool est éliminé en deux étapes grâce à des enzymes.
Dans un premier temps l'alcool est transformé en éthanal par
l'enzyme alcool déshydrogénase ( ADH). L'éthanal est une
substance très toxique, qui provoque des dégats dans l'ensemble de
l'organisme. Il attaque les membranes cellulaires et cause des domages
indirects en inhibant le système des enzymes. Dans un deuxième temps
l'éthanal est métabolysé par l'enzyme acétaldehyde déshydrogénase (
ALDH).
Spectroscopie.
On se propose d'étudier la structure et les fonctions organiques de ces
molécules par spectroscopie.
Représenter
les formules semi-développées de l'éthanol et de l'éthanal.
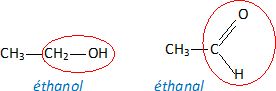
Quel
est le nom du groupe fonctionnel porté par l'éthanol ? A quelle famille
appartient cette molécule ?
OH : groupe hydroy. L'éthanol est un alcool primaire.
Quel est le nom du
groupe fonctionnel porté par l'éthanal ? A quelle famille appartient
cette molécule ?
C=O groupe carbonyle. L'éthanal est un aldehyde.
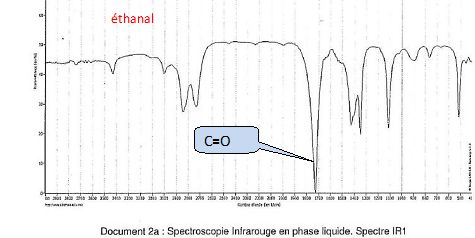
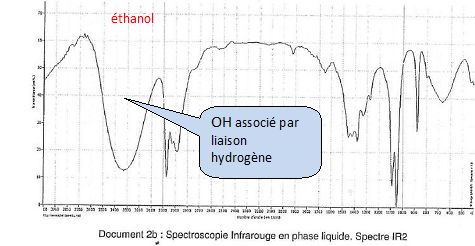
Associer chaque
spectre IR à la molécule correspondante en justifiant.
|
| .
. |
|
|
|
.
|
|
On donne
le spectre RMN de l'éthanol.
Associer
aux trois massifs du spectre, les groupes de protons équivalents de
l'éthanol.
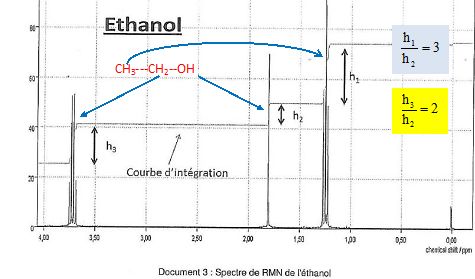
Le massif de pics situé au déplacement chimique 1,25 ppm se présente
sous forme d'un triplet.
Justifier
cette multiplicité.
Les 3 protons
équivalents du groupe méthyle CH3 sont couplés avec les n=2
protons équivalents du groupe CH2 : d'où la multiplicité du
signal n+1 = 2+1 = 3.
Mécanisme de
métabolisation des alcools.
La métabolisation des alcools implique leur oxydation en composés
carbonylés. dans les systèmes biochimiques, l'éthanol est transformé en
éthanal grâce à un oxydant noté NAD+. La réaction est
catalysée par une enzyme appelée alcool-déshydrogénase. En substituant
un atome d'hydrogène par un atome de deutérium D, on peut mettre
en évidence le rôle énantiosélectif de cette enzyme. En soumettant les
deux énantiomères du 1-deutérioéthanol à l'action de l'enzyme, on a pu
établir que l'oxydation biochimique était stéréospécifique, le NAD+
arrachant uniquement l'hydrogène marqué ci-dessous par une pointe de
flèche noire.
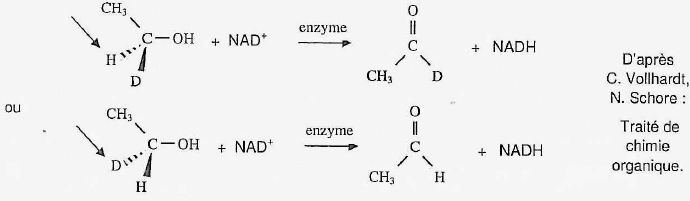
D désigne l'isotope 21H de l'hydrogène.
Quel est le nom de
la représentation chimique utilisée dans le mécanisme ci-dessus pour
l'alcool ?
L'alcool est schématisé en représentation de Cram
Que
représentent les traits pointillés et les traits épais ?
Les traits en pointillés représentent un liaison située derrière le
plan de la figure. Les traits épais représente une liaison vers l'avant
du plan de la feuille.
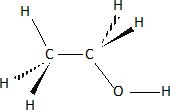
En
vous basant sur cette représentation, développer complètement la
molécule d'éthanol en faisant apparaître toutes les liaisons.
Quelle
particularité stéréochimique possède le carbone porteur du deutérium
dans la molécule de deutéroéthanol ? Comment nomme-t-on ce type de
molécule ?
Ce carbone est lié à 4 atomes ou groupes d'atomes différents : il est
dit " carbone asymétrique". Un molécule possèdant un atome de carbone
asymétrique est chirale : elle existe sous forme de deux énantiomères,
images l'un de l'autre dans un miroir.
L'éthanal
obtenu par oxydation se présente-t-il sous la forme d'un mélange
d'énantiomères ? Justifier.
Léthanal ne possède pas d'atome de carbone asymétrique et il possède un
plan de symétrie : l'éthanal obtenu n'est pas chiral, ce n'est pas un
mélange d'énantiomères.
La dégradation de l'éthanol dans l'organisme est une réaction
catalysée.
Donner
la définition d'un catalyseur. Quel type de catalyse est présentée ici
?
Un catalyseur est une espèce qui augmente la vitesse d'une
transformation, sans figurer dans l'équation de la réaction et sans
modifier la composition du système à l'état final.
La catalyse est enzymatique.
|
Dosage par spectrophotométrie de l'éthanol
On
désigne par vins doux, un vin ou un apéritif à base de vin ne titrant
pas plus de 18 degrés. On se propose de vérifier si un vin obéit à
cette législation.
Le titre alcoométrique, exprimé en degrés, est égal au nombre de litres d'éthanol contenus dans 100 L de vin.
M(éthanol) = 46,0 g/mol ; µ(éthanol) =0,78 g/L.
Afin de procéder au contrôle, on réalise le titrage par spectrophotométrie du vin en suivant le protocole suivant :
Première étape : on recueille l'éthanol du vin par distillation.
Deuxième étape : l'éthanol est oxydé par NAD+
dans une réaction catalysée par une enzyme spécifique similaire à celle
évoquée ci-dessus. La réaction produit de la
nicotinamide-adénine-dinucléotide ( NADH) en quantité de matière égale
à celle de l'éthanol dosé selon l'équation :
Ethanol + NAD+ ---> Ethanal +NADH + H+.
Troisième étape : la NADH absorbant dans le domaine UV, on mesure son absorbance par spectrophotométrie.
L'étalonnage du spectophotomètre avec différentes solutions d'éthanol permet de vérifier la loi de Beer-Lambert : A = kCm avec k = 1,6 10-3 L mg-1 et Cm la concentration massique d'éthanol dans l'échantillon.
Réalisation de la mesure
: on distille 10 mL de vin ; le distillat est ensuite ajusté à 100 mL
avec de l'eau distillée pour obtenir une solution S. On prépare
l'échantillon à doser par spectrophotométrie en introduisant dans une
fiole jaugée de 100 mL : 1 mL de solution S, le catalyseur, NAD+ en excès. On complète avec de l'eau distilée.
L'absorbance mesurée de cet échantillon est A0 = 0,15.
Déterminer Cm.
Cm = A0/k =0,15 / (1,6 10-3) = 93,75 ~94 mg/L.
En tenant compte des deux dilutions successives, calculer les concentrations massiques en éthanol suivantes :
Cs dans la solution S : le facteur de dilution est égal à 100.
Cs = 100 Cm =9,4 g/L.
Cv dans le vin : le facteur de dilution est égal à 10.
Cv = 10 Cs =94 g/L.
Quelle est la valeur du titre alcoométrique exprimé en degré du vin ? Conclure.
Volume d'alcool correspondant :
Cv / µ =93,75 / 0,78 = 120,2 ~1,2 102 mL = 0,12 L d'alcool par litre de vin ou 12 L d'alcool dans 100 L de vin ( 12 degrés).
Cette valeur étant inférieure à 18 degrès, il s'agit d'un vin doux.
|
|