Etude d'un bus
hybride. Bac Sti2d
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Etude énergétique.
Quelles sont les raisons de l'existence des périodes pour lesquelles la
vitesse est nulle ?
Le bus est à l'arrêt : montée ou descente des passagers, feux
tricolores, panneaux stop.
On considère que le mouvement du bus est horizontal entre les dates t 1=
25 s t 2 =65 s. Le graphe de l'évolution de la vitesse en
fonction du temps est donné ci-dessous.
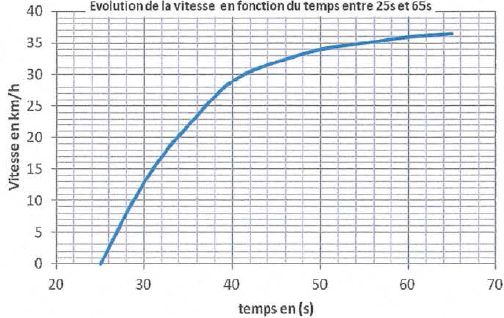 L'accélération
du bus entre ces deux dates est-elle constante ? Justifier.
L'accélération
du bus entre ces deux dates est-elle constante ? Justifier.
La vitesse est une primitive de l'accélération. Dans l'hypothèse d'une
accélération constante, la courbe représentant l'évolution de la
vitesse en fonction du temps est une droite. Or ce n'est pas le cas :
l'accélération du bus n'est pas constante.
Une seule des
trois relations suivantes permet le calcul de la valeur de
l'accélération, a. Laquelle ?
a = D(v). D(t) ; a = D(v) / D(t) ( exact ) ; a = D(v) /(2 D(t)).
On considère que le bus transporte 20 passagers de masse unitaire 70
kg. Calculer
la variation d'énergie cinétique de l'ensemble
{bus+conducteur+passagers} entre ces deux dates, t1 et t2.
E c t2 = ½mv 22 avec m = M bus
+ M passagers =17 500 + 20*70 = 18900 kg,
v 2 = 37,5 km/h = 37,5 /3,6 = 10,417 m/s.
Ec t2
=0,5*18900*10,4172 =1,025 106 J = 1,025 MJ.
Ec
t1 = ½mv21 avec v1 = 0 km/h.
Ec t2 -Ec t1 =1,025-0
~1,0 MJ.
Quel est le travail
du poids sur ce trajet ?
La route est horizontale, le poids est vertical : une force
perpendiculaire à la vitesse ne travaille pas.
On veut évaluer les différents
frottements au cours de ce mouvement.
Dans un premier temps, on prend en compte le frottement aérodynamique,
ou traînée. La traînée est une force qui s'oppose à l'avancement d'un
véhicule dans l'air. Elle devient très importante lorsque le
déplacement se fait à des vitesses élevées. Son intensité se calcule à
partir de la relation suivante.
T = ½C x r S v 2.
C x coefficient de traînée, sans unité ; r masse volumique du
fluide kg m -3 ; v vitesse m/s ; S maître couple m 2.
Le coefficient de traînée Cx vaut, dans notre cas, 0,5. On prend la
masse volumique de l'air r=
1,29 kg.m -3 et la surface (ou maître couple) de la
projection du véhicule sur un plan perpendiculaire au déplacement S =
8,41 m 2.
Quelle
est la valeur maximale de la traînée sur ce mouvement ?
T = 0,5 *0,5 *1,29*10,417 2 *8,41 = 286,7 ~2,9 10 2
N.
L'autre force de frottement est la force de contact notée F c
(entre l'ensemble des pneus et la chaussée). Elle est définie par la
relation ci-dessous : F c = KM Tg. Calculer son
intensité dans les conditions du déplacement.
K = 0,028 ; M T =18900 kg ; g = 9,81 SI.
F c = 0,028*18900*9,81 = 5,194 10 3 ~5,2 10 3
N.
Au vu des valeurs de ces deux frottements, et en considérant que l'on
peut négliger une force par rapport à l'autre si celle-ci est au moins
10 fois plus faible, quel frottement
pouvons-nous conserver dans l'étude ?
On peut conserverla force de frottement de contact.
On étudie ci-dessous le démarrage du bus allant d'une vitesse nulle à
celle de 20 km/h.
Déterminer
la durée nécessaire pour atteindre une vitesse de 20 km.h-1.
Sur le graphe représentant l'évolution de la vitesse, on lit Dt = 34-25 = 9,0 s..
Sur cette durée, on considérera l'accélération constante et égale à
0,60 m.s -2.
Évaluer
la distance parcourue durant cette phase où la traction est
exclusivement électrique. On rappelle que la distance d est
donnée par : d = ½at 2 + v 0t.
d = 0,5*0,60 * 9 2 = 24,3 ~24 m.
Tracer
l'allure du vecteur représentant la force de contact Fc et
du vecteur représentant la force motrice FM.
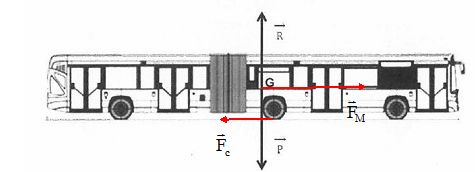
En
supposant la force de frottement horizontale et opposée au sens du
mouvement, calculer
le travail de la force Fc sur ce petit déplacement d. Quel est
son signe?
Le travail de la force de frottement est résistant : W Fc = -F c
d = -5,194 10 3 *24,3 = -1,262 10 5 ~1,3 10 5
J.
Montrer à
l'aide du théorème de l'énergie cinétique que le travail de la force
motriceWFm vaut 418 kJ.
DE c =
0,5 *18900*(20/3,6) 2 -0 = 2,917 10 5 J.
DEc =WFc +WFM ; WFM
=2,917 105
+1,262 105
=4,179 105 ~4,2 105 J.
En
déduire la puissance motrice minimum Pmini sur ce déplacement.
P mini = WFM / Dt = 4,179 105
/9 =4,643 104 ~4,6 104 W.
En supposant le rendement de la transmission égal à 1, calculer la
puissance utile minimum délivrée par le moteur. 4,6 104 W = 46 kW.
Comparer
cette valeur avec celle de la documentation 200 kW crète ).
Pourquoi le constructeur prévoit-il une valeur de puissance crête
nettement supérieure ?
Le bus peut emporter plus de 20 passagers et aborder des montées.
|
|
|
Etude de la
batterie.
Elle comporte 16 modules identiques ; dans chaque module, on retrouve
96 accumulateurs élémentaires lithium-ion dont la tension aux bornes
vaut 3,33V. Ces accumulateurs sont branchés en série.
On constitue 8 assemblages de 2 modules montés en série. Ces 8
assemblages sont eux
montés en parallèle. Le temps de recharge est d'environ 3 heures. La
tension disponible aux bornes de l'ensemble (mesurée en sortie de la
batterie) est de 640 V.
Schématiser
le montage des modules au sein de la batterie. Justifier que la tension
disponible aux bornes de l'ensemble est bien de 640V.
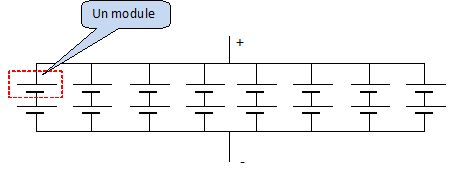
Tension aux bornes de 96 accumulateurs en série : 96*3,33 = 319,68 V.
Tension aux bornes de 2 modules en série : 2*319,68 = 639,36 ~639 V.
Tension aux bornes de 8 assemblages parrallèles de 2 modules en
série : 639 V.
Le fabriquant indique une charge électrique maximale de 43200 C
pour un module ; déterminer la valeur
du courant de charge de la batterie pour une durée de charge moyenne de
3,00 h.
Intensité traversant un module : I = Q/t = 43200 / (3,00*3600) = 4,0 A.
Intensité traversant deux modules en série : 4,00 A.
Intensité traversant 8 assemblages en parallèle : 8*4,00 = 32,0 A.
La borne positive de l'accumulateur est formée d'un matériau
accueillant des ions lithium, Li+. Pour le bilan
électronique, on peut formellement modéliser les processus qui s'y
déroulent par l'équation du couple Li+/Li. On étudie
ci-dessous le fonctionnement de cette électrode lors de la décharge.
Écrire
l'équation de la réaction qui se produit à cette électrode. Donner le
nom de cette transformation.
Lors de la décharge, le pôle positif est une cathode positive. Une
réduction des ions lithium se produit à la cathode : Li++e-
---> Li.
La
transformation qui se produit dans la pile, dans ces conditions,
est-elle spontanée ou forcée ?
Lors de la décharge de la pile, la transformation est spontanée.
En considérant la décharge totale d'un accumulateur élémentaire, calculer la quantité
d'ions Li+ consommée et la
masse de lithium formée à la borne positive.
On donne 1 Faraday= 96500 C.mol-1 ; masse molaire atomique
du lithium M= 7,0 g.mol-1.
Pour un accumulateur élémentaire Q = 43200 / 96 =450 C
Quantité de matière d'électron : n = Q/F = 450 / 96500 = 4,663 10-3
mol.
Quantité de matière de lithium : 4,663
10-3 mol.
Masse de lithium : 4,663
10-3 *7,0 = 3,26 10-2 g ~33 mg.
|
.
|
|
Gestion de la
température de l'habitacle conducteur.
Ce type de véhicule présente un poste de conduite semi cloisonné et
équipé d'une climatisation à destination du chauffeur.
Les graphes suivants, donnent pour le premier, la puissance des
radiations émises par le soleil, et pour le second, la transmission par
le type de vitre athermique étudiée en fonction de la
longueur d'onde.
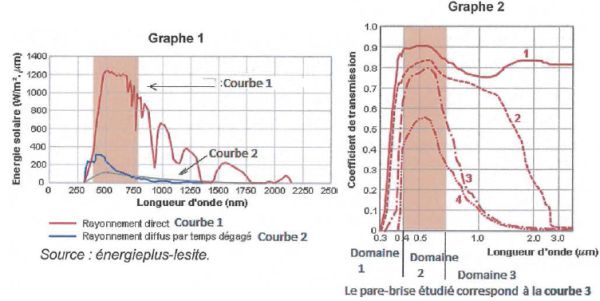
Sur les graphes sont repérés trois domaines de longueur d'onde. Attribuer à chaque
domaine un type de rayonnement à choisir parmi : infrarouge,
ultraviolet et visible.
Domaine 1 : UV ; domaine 2 : visible ; domaine 3 : infrarouge.
Déterminer
le pourcentage maximal de transmission du pare-brise (correspondant à
la courbe 3) pour la lumière visible.
Sur le graphe 2, courbe 3, on
lit 0,8.
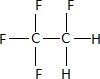
Donner
la formule développée plane du 1, 1, 1,2-tétrafluoroéthane,
sachant que le carbone établit quatre liaisons, l'hydrogène une liaison
et le fluor une liaison.
On raisonne maintenant sur une quantité de matière d'une mole de R-134a
(1, 1, 1,2-tétrafluoroéthane).
Calculer
la masse molaire du R-134a puis l'énergie nécessaire pour la
vaporisation d'une mole de ce fluide frigorigène à son point
d'ébullition.
M (C2H2F4)= 12*2+2+4*19 =102 g/mol.
Chaleur latente de vaporisation (1,5 bar au point d'ébullition) : Lv
= 215,9 kJ/kg.
M Lv = 0,102 *215,9 = 22,0218 ~22,0 kJ.
D'où
provient l'énergie nécessaire à la vaporisation d'une mole de R-134a?
De la cabine du conducteur.
Quelle
solution proposez vous afin de réduire au maximum la température dans
l'habitacle conducteur de façon écologique et économique ?
Les pare-brises atermiques transmettent le rayonnement visible et
réfléchissent le rayonnement infrarouge.
Utiliser une peinture claire pour la carrosserie, bien isoler entre
toile de pavillon et tôle.
Afin de rendre l'emploi de produits nettoyants
sûr et efficace, on se propose de rédiger une note à destination du
personnel intervenant pour le nettoyage des bus.
Dans un premier temps, le sol du bus est nettoyé abondamment à l'eau de
Javel. Ensuite, avant le rinçage des sols, une seconde personne décide
d'appliquer sur l'équipement intérieur
et les surfaces intérieures des vitres, une solution contenant de
l'acide éthanoïque. Par écoulement, une partie de cette solution acide
entre en contact du sol et donc avec l'eau de Javel. Le personnel
observe un léger dégagement gazeux irritant et décide d'évacuer les
lieux.
Nommer la(les)
protection(s) indispensable(s) à l'usage des produits d'entretien.
L'eau de Javel est corrosive : port de blouse, gants et lunettes.
Sachant que l'eau de Javel contient des ions hypochlorite, ClO-(aq)
, qui appartiennent au couple ClO-aq / Cl-aq, écrire la
demi-équation de réduction de l'ion hypochlorite en milieu
acide.
ClO-aq +2H+aq + 2e- = Cl-aq
+ H2O.
Nommer le gaz produit lors de la réaction entre l'eau de Javel et la
solution d'acide éthanoïque. Quelle demi-équation pouvez-vous alors
écrire concernant le couple Cl2aq / Cl-aq) ?
Il se produit du dichlore Cl2. 2Cl-aq =Cl2+
2e-.
En
déduire l'équation chimique globale traduisant ce qui se passe sur le
sol du bus.
ClO-aq +2H+aq + Cl-aq =Cl2
+ H2O.
Sur un blog, on peut lire que le nettoyage est plus efficace en
mélangeant de l'eau de Javel et du vinaigre blanc (solution diluée
d'acide éthanoïque). Commenter.
Il ne faut pas mélanger l'eau de Javel avec un produit acide. Il se
formerait du dichlore, gaz toxique.
|
|
|