Ethylotest,
ibuprofène : la molécule, titrage, circulation sanguine, distance
d'arrêt.
Bac St2S
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Ethylotest.
L’éthylotest chimique permet de contrôler le taux d’alcool contenu dans
l’air expiré d’un automobiliste.
Il est constitué d’un ballon en plastique de volume 1,0 L muni d’un
embout transparent rempli d’un gel contenant des ions dichromate (Cr 2O 7
2-) orange. L’automobiliste souffle
dans le ballon afin de le remplir totalement, celui-ci est ensuite
adapté sur l’embout. Le ballon est entièrement vidé, l’air expiré par
l’automobiliste passe ainsi par le gel contenant les ions dichromate.
L’éthanol contenu dans l’air expiré est oxydé par les ions dichromate
(Cr 2O 7 2-),
orange, pour former entre autre des ions chrome (Cr 3+),
vert.
L'équation de la réaction se produisant entre les ions dichromate et
l'éthanol en milieu acide (les ions « H + » sont
en excès) est : 3 C 2H 5OH
+ 2 Cr 2O 72-+
16 H + ---> 3 CH 3
COOH + 4 Cr 3++ 11 H 2O.
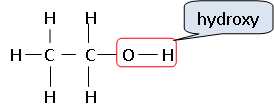
Écrire
la formule développée de l’éthanol. Entourer le groupe caractéristique.
 Donner
les noms des molécules formées au cours de cette réaction
Donner
les noms des molécules formées au cours de cette réaction.
CH 3COOH : acide éthanoïque ou acétique ; H 2O
: eau.
Les deux couples redox mises en jeu lors de cette réaction sont : Cr2O72-/ Cr3+;
CH3 COOH /C2H5OH.
Les
ions dichromate jouent-ils le rôle d’oxydant ou de réducteur dans cette
réaction ? Proposer une explication.
Les ions dichromates jouent le rôle d'oxydant ; ils gagnent des
électrons et se réduisent.
Cr2O72-aq +14H+aq + 6 e-
= 2Cr3+aq +7H2O.
Au
cours de la réaction, l’éthanol subit-il une oxydation ou une réduction
? Proposer une explication.
L'éthanol joue le rôle de réducteur et s'oxyde, il céde des électrons.
C2H5OH +H2O=
CH3
COOH +4H+ + 4e-.
En France, la
concentration massique d’éthanol dans le sang d’un automobiliste doit
être inférieure à la valeur limite Cmax = 0,50
g.L-1. La masse d'éthanol contenue dans un litre
de sang est deux mille fois supérieure à celle contenue dans un litre
d'air expiré. On considère un automobiliste ayant une concentration
massique de 4,0 x 10- 4 g.L-1
d’éthanol dans l'air qu'il expire.
Quelle
est la concentration massique d’éthanol dans le sang de cet
automobiliste ?
4,0 x 10- 4 *2000
=0,8 g / L.
Est-il en
infraction ? Proposer une explication.
0,8 g/L est supérieure à Cmax : il y a
infraction.
Le tube de l’éthylotest est conçu de telle façon que, pour
une personne ayant un taux d’éthanol supérieur à la valeur maximale,
les ions dichromate disparaissent totalement.
Quelle
est la couleur finale dans le tube lorsqu’une personne est contrôlée
positive ? Proposer une explication.
Les ions dichromate orangé ont tous été réduits ; il se forme
des ions Cr3+ vert, seule espèce colorée.
Médicaments
et conduite.
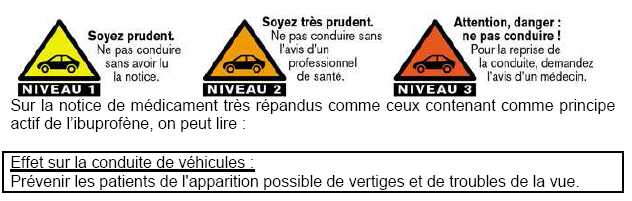
Les
médicaments peuvent avoir des conséquences incompatibles avec la
conduite. Des pictogrammes sur les boites informent du niveau de
risque. Il y en a 3 :
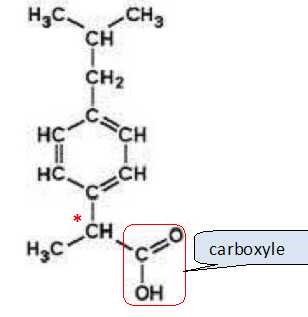
La molécule d’ibuprofène est représentée ci-dessous.
Sur
la formule semi-développée de la molécule d’ibuprofène entourer et
nommer le groupe caractéristique.
Donner
la définition d’un atome de carbone asymétrique et le repérer par un
astérisque * sur la molécule d’ibuprofène.
Un atome de carbone asymétrique est tétragonal et lié à quatre atomes
ou groupes d'atomes différents.
La
molécule d’ibuprofène est-elle chirale ? Expliquer.
Une molécule possèdant un atome de carbone asymétrique est chirale.
Dosage
d’un comprimé d’un médicament contenant de l’ibuprofène.
On souhaite vérifier la masse d’ibuprofène présente dans un comprimé
provenant d’une boîte de médicaments dosés à 400 mg. Pour cela on
réalise le protocole expérimental ci-dessous :
- Broyer le comprimé.
- Dissoudre le comprimé broyé avec 30 mL d’éthanol.
- Filtrer le mélange.
- Évaporer l’éthanol du filtrat, un solide blanc est obtenu.
- Dissoudre le solide dans 100 mL d’eau.
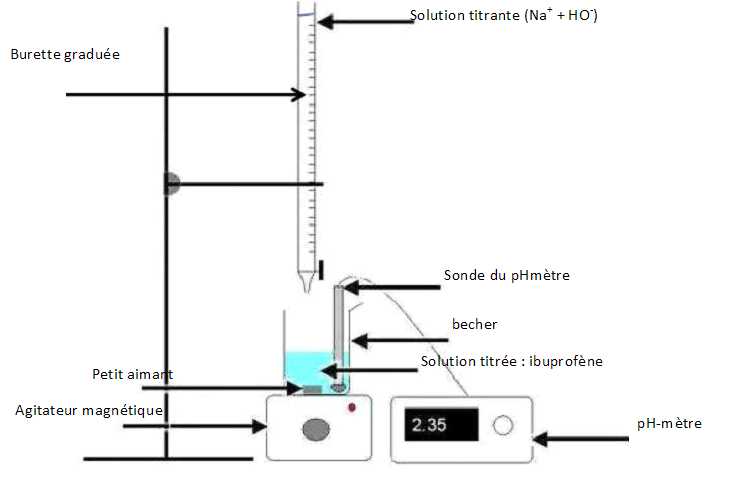
- Titrer cette solution par une solution aqueuse d’hydroxyde de sodium
(Na+ + HO-) de
concentration molaire c = 0,10mol/L. - Le titrage est suivi par
pH-métrie. Dans la suite de l’exercice, la molécule d’ibuprofène sera
notée : R-COOH. L’équation de la réaction du titrage est :
R-COOH + HO ---->R-COO -
+ H2O.
Pourquoi
faut-il dissoudre le comprimé dans l’éthanol, puis filtrer le mélange
?
L'ibuprofène est soluble dans l'éthanol et les excipients sont
insolubles dans ce solvant.
|
|
|
Compléter
le schéma du titrage donné.
Parmi les
courbes ci-dessous, quelle est celle correspondant au titrage étudié
?
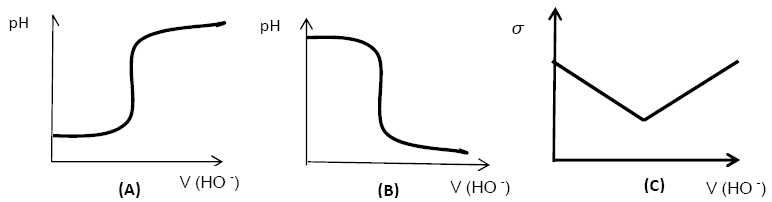
Courbe A : la solution initiale est
acide et la solution finale est basique.
Définir
l’équivalence du titrage.
A
l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'ibuprofènee est
en excès ; après l'équivalence, l'hydroxyde de sodium est en
excès.
On obtient un
volume à l’équivalence VE= 19,3 mL.
Calculer
la quantité de matière d’ion hydroxyde n (HO -)
versé à l’équivalence.
n(HO-) = cVe = 0,10 * 19,3 10-3
=1,93 10-3 mol.
En
déduire la quantité de matière d’ibuprofène présente dans les 100 mL de
la solution titrée.
n(ibuprofène ) = n(HO-)
=1,93 10-3 mol.
Calculer
la masse d’ibuprofène mibuprofène contenu dans le comprimé.
M(ibuprofène)= M = 206,3 g/mol.
n(ibuprofène ) M = 1,93 10-3
*206,3 =0,398 g = 398 mg.
Est-ce en
accord avec l’indication sur la boîte de médicaments ? Expliquer.
Ecart relatif ( 400-398) / 400 = 0,005 ( 0,5%). Le résultat est en
accord avec l'indication de la boîte.
Le sang est une solution tampon dont le pH est de 7,4.
À
l’aide d’un diagramme de prédominance, indiquer quelle forme acide ou
basique de l’ibuprofène prédomine dans le sang. Donnée : pKa
(R-COOH/R-COO-) = 4,54 à 25 °C.
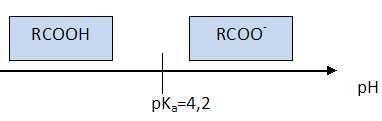
A pH supérieure à pKa,
la forme RCOO- prédomine.
Expliquer
pourquoi on ne pourrait pas réaliser le dosage précédent sur un
prélèvement sanguin.
Dans le sang, à pH =7,4, l'ibuprofène se trouve sous la forme basique
RCOO-.
|
.
|
|
La
circulation sanguine.
Certains médicaments (par exemple contre le mal des transports ou
contre les nausées), et la consommation excessive d’alcool, de
cannabis, de cocaïne et d’autres drogues peuvent provoquer des
mydriases c’est-à-dire des dilatations anormales de la pupille. Un
conducteur qui est dans cet état est donc plus sujet aux éblouissements
des phares d’un autre véhicule par exemple.
Ils provoquent également la vasodilatation des vaisseaux sanguins. Cela
a pour conséquence des yeux rouges et une variation de la pression
sanguine.
Le sang s’écoule dans un vaisseau sanguin considéré comme cylindrique
de section S = 6,4x10-5 SI.
En régime permanent laminaire, le débit en volume est de D = 2,8 L.min-1.
Définir
le débit en volume (ou débit volumique).
Le débit volumique ( m3 s-1)
est le volume de sang ( m3) qui s'écoule en une
seconde.
Vérifier
que le débit en volume vaut 4,7x10-5
m 3.s-1.
D = 2,8 10-3 / 60 = 4,6666 10-5
~4,7 10-5 m 3.s-1.
On
peut exprimer le débit en volume en fonction de la vitesse d’écoulement
v : D = S x v
Donner
les unités des grandeurs physiques S et v dans le système international.
S s'exprime en m2 et la vitesse en ms-1.
Calculer
la vitesse d’écoulement v du sang dans le vaisseau sanguin considéré.
v = D/S = 4,7 10-5 /(6,4 10-5) =0,73 m/s.
En
régime permanent, le débit en volume conserve la même valeur à travers
toute section droite du vaisseau dans laquelle le sang circule.
Comment
varie la vitesse d’écoulement lorsqu’un automobiliste est sous
l’emprise de cannabis qui a un effet vasodilatateur ?
La section des vaiseaux augmente ; le débit volumique reste constant ;
en conséquence la vitesse d'écoulement du sang diminue.
Le débit en volume est proportionnel à la perte de charge : D = Dp/R.
La résistance hydraulique R du vaisseau sanguin cylindrique diminue
avec le rayon.
Comment
varie la pression sanguine lorsqu’un automobiliste est sous l’emprise
de cannabis ?
Le débit volumique reste constant ; la section du vaisseau augmente et
en conséquence, la résistance hydraulique croît. Dp augmente et la
pression sanguine diminue.
Le temps de réaction.
À
l’aide du diagramme ci-dessous, définir la distance d’arrêt.
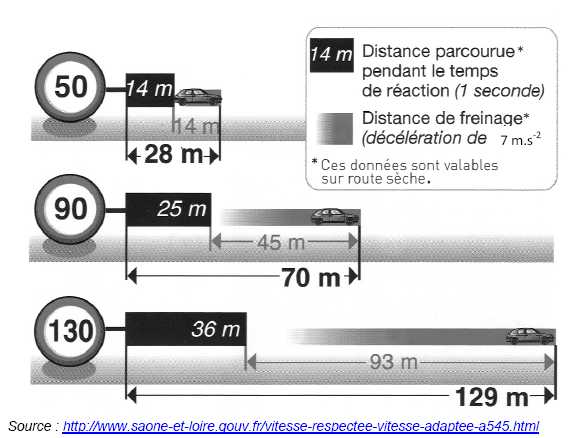
La distance d'arrêt est égale à la somme de la distance de freinage et
de la distance parcourue pendant le temps de réaction.
Quelle(s)
est (sont) la(les) distance(s) qui va (vont) varier lorsqu’un
automobiliste est sous l’emprise de produits stupéfiants ?
La distance parcourue pendant le temps de réaction ( et en
conséquence la distance d'arrêt ) dépend de l'état du conducteur.
Quelle
est la distance d’arrêt à 90 km.h-1 sur route
sèche lorsque le temps de réaction a doublé ?
Distance parcourue pendant le temps de réaction : 25*2 = 50 m.
Distance de freinage : 45 m ; distance d'arrêt : 50+45 = 95 m.
Citer
un facteur pouvant influer sur la distance de freinage.
L'état général de la voiture, en particulier
pneus et freins ; l'état
de la route ( sèche, humide, présence de verglas ou de gravillons ).
|
|
|






