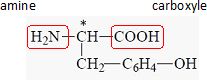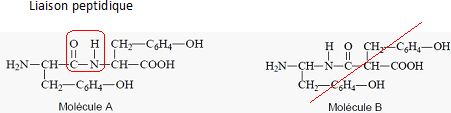La tyrosine,
dipeptide, dosage du lugol. Bac ST2S 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
La tyrosine.
Définir
le terme acide a-aminé.
Un acide a-aminé possède un groupe amine et un groupe acrboxyle ( acide
carboxylique ) portés par le même atome de carbone.
Entourer et nommer
les groupes responsables de l'appartenance de la tyrosine à la famille
des acides a-aminés.
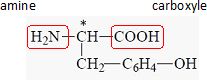
Comment
qualifie-t-on le carbone repéré par un astérisque.
Cet atome de carbone est
asymétrique. Il est tétragonal et relié à 4 atomes ou groupes d'atomes
différents.
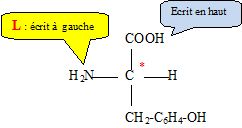
Donner
la représentation de Fischer de l'un des deux énantiomères de la
tyrosine, en précisant la configuration.
Condensation
entre deux acides aminés.
Cette réaction conduit à un dipeptide.
Parmi les formules
semi-développées proposées, indiquer celle qui correspond au dipeptide
formé à partir de la tyrosine.
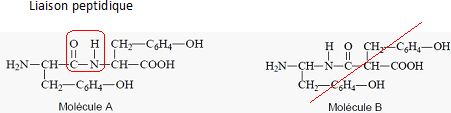
Donner
le nom de ce dipeptide en utilisant l'abréviation Tyr.
Tyr-Tyr.
Lors de la condensation une autre molécule est formée en même temps que
le dipeptide.
Donnée son nom.
Il se forme une molécule d'eau.
Si
on ne prend aucune précaution supplémentaire, un ou plusieurs autres
dipeptides pourront-ils être formés lors de cette condensation ?
Justifier.
On peut obtenir 4 dipeptides différents à partir de
deux acides aminés, chaque molécule d'acides
aminés possédant un groupe amine un groupe acide carboxylique.
Deux
molécules de leucine peuvent réagir ensemble et conduire au dipeptide
Leu-Leu. De même pour l'isoleucine, le dipeptide étant isoleu-isoleu ou
Ile-Ile.
La leucine peut réagir avec l'isoleucine et conduire à deux dipeptides
: Leu-isoleu , isoleu-Leu.
Les dipetides obtenus possédant des groupes NH2 et COOH
peuvent continuer à réagir en formant des tripeptides, puis des
polypeptides.
|
|
|
L'hyperthyroïdie est
un dérèglement hormonal causé entre autre par un excès de Thyrosine
libre ( T4L). Le document suivant est un extrait de bilan thyroïdien.

le
médecin est-il amené à demander des examens complémentaires ? Justifier.
Non. La thyrosine libre est dans la norme ainsi que le TSH 3è
génération.
|
.
|
|
La solution de
Lugol.
Une solution de Lugol contient une masse m égale à 15 g de diiode (I2) pour V=100 mL de solution.
Calculer la masse molaire du diiode I2.
Masse molaire de l'iode M(I) = 127,0 g.mol-1.
M(I2) = 2*127 = 254 g /mol.
Montrer que dans un volume de 100 mL de la solution de Lugol
utilisée pour traiter une hyperthyroïdie la quantité de matière de
diiode dissous est égale à 5,9 x10 –2 mol.
n = m/M(I2) = 15 / 254 = 5,9 10-2 mol.
En déduire la concentration molaire en diiode de la solution de
Lugol.
[I2] = n / V = 5,9 10-2 /0,100 = 0,59 mol/L.
Dosage de la solution de Lugol.
On désire vérifier qu'une solution de Lugol est bien adaptée au
traitement primitif d'une hyperthyroïdie. Pour cela, on détermine par
dosage sa concentration molaire en diiode.
Protocole du dosage.
•Verser un prélèvement de 10,0 mL de la solution de Lugol dans un erlenmeyer.
•Y ajouter quelques gouttes d'empois d'amidon.
•Verser dans une burette graduée une solution de thiosulfate de sodium
de concentration molaire connue. Eliminer la bulle d'air formée au bas
de la burette et ajuster précisément la surface du liquide à la
graduation zéro.
•Verser mL par mL la solution de thiosulfate de sodium jusqu'à observer
unchangement de couleur du mélange réactionnel (dosage rapide).
•Refaire un dosage, en tenant compte du résultat du dosage rapide, afin
dedéterminer de manière précise le volume de solution de thiosulfate de
sodium versé pour atteindre l'équivalence.
Parmi
la verrerie proposée, indiquer la lettre de celle qui est la plus
adaptée pour réaliser le prélèvement d’un volume égal à 10,0 mL de
solution de Lugol. Nommer la verrerie choisie..
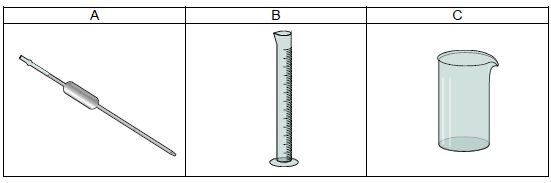
La pipette jaugée A permet de mesurer un volume précis.
Pour quelle raison faut-il éliminer la bulle d'air formée à la base de la burette graduée avant de réaliser le dosage ?
Le volume équivalent VE de thiosulfate de sodium doit être le plus précis possible.
Lors du dosage, le diiode contenu dans le Lugol se transforme en ions iodure. La demi-équation correspondante est la suivante :
I2 + 2 e– = 2 I–.
Le diiode joue-t-il le rôle d’un oxydant ou d’un réducteur ? Justifier la réponse.
Le diiode gagne des électrons, c'est un oxydant qui se réduit.
Définir l'équivalence d'un dosage.
A l'équivalence les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès ; après l'équivalence, l'autre réactif est en excès.
La concentration molaire C1 en ions thiosulfate de la
solution utilisée pour le dosage est égale à 0,80 mol/L. L’équivalence
est atteinte lorsqu'un volume V1 égal à 15,0 mL de la solution de thiosulfate de sodium a été versé.
Expliquer succinctement la manière dont on refait le dosage pour obtenir le volume V1 avec le plus de précision possible, compte tenu du résultat du dosage rapide.
On ajoute rapidement 14 mL de la solution de thiosulfate de sodium,
puis l'ajout se fait goutte à goutte jusqu'au changement de teinte de
la solution.
Déterminer la quantité de matière notée n1 en ions thiosulfate versée.
n1 = C1V1 =0,80 *0,0150 = 0,012 mol.
L'équation de la réaction qui a lieu lors du dosage est la suivante :
2 S2O32– + I2 --->S4O62– + 2 I –.
Montrer que le prélèvement d’un volume de 10,0 mL de la solution de Lugol contient une quantité de matière de diiode n2 égale à 6,0x10 –3 mol.
D'après les nombres stoechiométriques de l'équation, n2 = ½n1 = 0,012 /2 = 6,0 10-3 mol.
En déduire la concentration molaire C2 en diiode de la solution de Lugol dosée.
c2 = n2 / (10,0 10-3) =6,0 / 10 = 0,60 mol/L.
Ce résultat est en accord avec la valeur trouvée ci-dessus ( 0,59
mol/L), l'écart relatif étant : (0,60-0,59) / 0,59 *100 ~1,7 %.
|
|
|