Contrôle de
qualité d'un lait. Bac S Pondichéry 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Le
lait de vache est un liquide biologique de densité 1,03. Il est
constitué de 87 % d’eau, 4,7 % de lactose et de 3,5 à 4 % de matières
grasses (proportions en masse). Il renferme aussi de la caséine, des
vitamines A et D, et des ions minéraux : calcium, sodium, potassium,
magnésium, chlorure…
L’industrie laitière met en oeuvre divers contrôles de qualité du lait,
avant de procéder à sa transformation (production de yaourts par
exemple) ou à sa commercialisation. Cet exercice est consacrée à deux
de ces tests : la détermination de l’acidité Dornic et le dosage de la
teneur en ions chlorure.
Données pK a du couple acide lactique / ion lactate : pK a (C 3H 6O 3 / C 3H 5O 3 - ) = 3,9 à 25 °C Conductivité molaire ionique à 25°C ( mS m 2 mol -1) : lAg+ = 6,19 ; lCl- = 7,63 ; lNO3- = 7,14.
Couleurs et zone de virage des indicateurs colorés usuels
Indicateur coloré
|
Teinte de la forme acide
|
Zone de virage
|
Teinte de la forme basique
|
Hélianthine
|
rouge
|
3,1 ; 4,4
|
jaune
|
Bleu de bromothymol
|
jaune
|
6 ; 7,6
|
bleu
|
Phénolphtaléine
|
incolore |
8 ; 10
|
rose |
Courbe de titrage suivi par pH-métrie de 20,0 mL de solution d’acide lactique de concentration molaire 3,00 x 10-2 mol.L-1 par une solution d’hydroxyde de sodium de concentration molaire 5,00 x 10-2 mol.L-1:
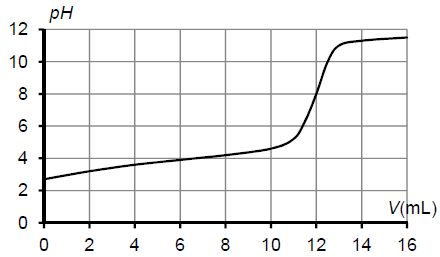
|
| .
. |
|
|
Document. L’échelle d’acidité Dornic
Un lait frais est légèrement acide, son pH est compris entre 6,6 et
6,8. Cependant, le lactose subit naturellement une dégradation
biochimique progressive sous l’effet des bactéries, et il se transforme
en acide lactique. En conséquence, plus le pH du lait est faible et
moins il est frais.
L’industrie laitière utilise le degré Dornic pour quantifier l’acidité
d’un lait. Cette unité doit son nom à Pierre Dornic (1864 – 1933),
ingénieur agronome français. Un degré Dornic (1 °D) correspond à 0,1 g
d’acide lactique par litre de lait. Pour être considéré comme frais, un
lait doit avoir une acidité inférieure ou égale à 18 °D.
Entre 18 °D et 40 °D, le lait caille (il « tourne ») lorsqu’on le
chauffe ; c’est la caséine qui flocule. Au-delà de 40 °D, il caille à
température ambiante. Les yaourts ont une acidité Dornic généralement
comprise entre 80 °D et 100 °D.
Tableau de correspondance entre acidité Dornic et pH du lait :
Acidité Dornic ( °D)
|
pH
|
inférieure à 18
|
entre 6,6 et 6,8
|
20
|
6,4
|
24
|
6,1
|
entre 55 et 60
|
5,2
|
.
|
.
|
|
Méthode Dornic.
Un technicien dose l’acidité d’un lait selon la méthode Dornic.
C’est-à-dire qu’il réalise le titrage à l'aide d'une solution aqueuse
d’hydroxyde de sodium (Na(aq)+ +HO(aq)- ) à 0,111 mol.L-1,
appelée soude Dornic. Il prélève 10,0 mL de lait, y ajoute deux gouttes
de phénolphtaléine et verse la soude Dornic goutte à goutte en agitant
le mélange, jusqu'à obtenir une couleur rose pâle. Le volume de soude
versée est alors de 2,1 ± 0,1 mL.
On admettra que l’acidité du lait est uniquement due à l’acide lactique.
Des ions lactate sont-ils présents dans un lait quel que soit son état de fraîcheur ? Justifier.
pKa du couple acide lactique / ion lactate : 3,9.
Le pH du lait, quel que soit son état de fraicheur, est supérieur au pKa : les ions lactate sont majoritaires par rapport à l'acide lactique.
Ecrire
l’équation de la réaction support du titrage, en supposant que le seul
acide présent dans le lait est l’acide lactique.
C3H6O3 aq + HO-aq --> C3H5O3 - aq +H2O.
Justifier le choix de la phénolphtaléine comme indicateur de fin de réaction.
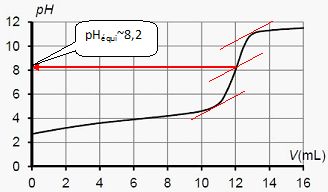
Le pH du point équivalent doit appartenir à la zone de virage de l'indicateur coloré.
Pourquoi n’ajoute-t-on que deux gouttes de phénolphtaléine ?
La phénolphtaléine appartient à un couple acide/base dont les deux
espèces ont une couleur différente. La forme acide réagit donc
avec l'ion hydroxyde lors du titrage ; si on ajoutait une quantité
importante d'indicateur coloré, le volume équivalent serait faussé.
Le lait dosé est-il frais ? Un raisonnement argumenté et des calculs rigoureux sont attendus.
Quantité de matière de soude à l'équivalence : 0,111 *2,1 10-3=0,233 10-3 mol
Quantité de matière d'acide lactique dosé : 0,233 10-3 mol dans 10,0 mL de lait soit 0,0233 mol par litre.
Masse molaire de l'acide lactique : M =3*12+6+3*16=90 g/mol.
Masse d'acide lactique dans un litre de lait : 90*0,0233 ~2,1 g /L soit 21 °D.
Cette valeur étant supérieure à 18°D, le lait n'est pas frais.
Quel intérêt pratique y-a-t-il à choisir de la soude Dornic pour mesurer l’acidité d’un lait ?
Le volume de soude versé à l'équivalence multiplié par 10 donne directement le degré Dornic.
Détermination de la teneur en ions chlorure.
La mammite est une maladie fréquente dans les élevages de vaches
laitières. Il s’agit d’une inflammation de la mamelle engendrant la
présence de cellules inflammatoires et de bactéries dans le lait. La
composition chimique et biologique du lait est alors sensiblement
modifiée. La concentration de lactose diminue, tandis que la
concentration en ions sodium et en ions chlorure augmente. Cette
altération du lait le rend impropre à la consommation. Dans le lait
frais normal, la concentration massique en ions chlorure est comprise
entre 0,8 g.L-1 et 1,2 g.L-1.
Pour un lait « mammiteux », cette concentration est égale ou supérieure à 1,4 g.L-1.
Dans un laboratoire d’analyse, une technicienne titre 20,0 mL de lait
mélangé à 200 mL d’eau déminéralisée par une solution de nitrate
d’argent (Ag(aq)+ +NO3(aq)- ) de concentration molaire
5,00 x 10-2 mol.L-1. Les ions argent réagissent
avec les ions chlorure pour former un précipité de chlorure d’argent
AgCl(s). Le titrage est suivi par conductimétrie. Le volume équivalent
déterminé par la technicienne est 11,6 ± 0,1 mL.
Ecrire l’équation de la réaction support du dosage.
Ag(aq)+ +Cl-aq ---> AgCl(s).
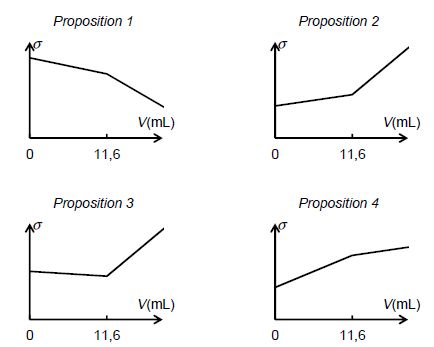
Parmi
les représentations graphiques suivantes, quelle est celle qui
représente l’allure de l’évolution de la conductivité s du mélange en
fonction du volume V de solution de nitrate d’argent versé ? Justifier.
Avant l'équivalence les ions argent sont en défaut. Du point de vue de
la conductivité tout se passe comme si on remplaçait l'ion chlorure par
l'ion nitrate, de conductivité ionique molaire légèrement inférieure.
La conductivité de la solution diminue légèrement. Après l'équivalence
l'ion argent est en excès et la conductivité croît. La proposition 3
convient.
|
|
Le lait analysé est-il « mammiteux » ? Une réponse argumentée et des calculs rigoureux sont attendus.
Quantité de matière d'ion argent à l'équivalence : 11,6 10-3*5,00 10-2 =5,80 10-4 mol.
Quantité de matière d'ion chlorure dosé : 5,80 10-4 mol dans 20 mL de lait soit 5,80 10-4 /(20,0 10-3)=2,90 10-2 mol/L.
Concentration massique en ion chlorure : 35,5 * 2,90 10-2 =1,03 g/L.
Cette valeur étant comprise entre 0,8 g.L-1 et 1,2 g.L-1 le lait est normal ( non mamiteux ).
|
|
|