Synthèse de
l'acétate d'éthyle. Bac S Pondichéry 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
L'acétate
d'éthyle est un liquide utilisé comme solvant pour les vernis à ongles
et certaines colles, en raison de sa faible nocivité et de sa
volatilité importante. Il est aussi utilisé dans l’industrie
agroalimentaire dans certains arômes fruités.
La synthèse de l’acétate d’éthyle est facilement réalisable au
laboratoire. Un exemple de
protocole expérimental est décrit ci-dessous :
Etape 1.
Dans un ballon de 100 mL, introduire un mélange équimolaire de 0,10 mol
d'acide acétique et 0,10 mol d'éthanol. Y ajouter 0,5 mL d'acide
sulfurique concentré (H 2SO 4(l)) et quelques
grains de pierre ponce. Porter le mélange à ébullition dans un
dispositif de chauffage à reflux pendant 30 minutes.
Etape 2.
Laisser refroidir le mélange réactionnel à l’air ambiant puis dans un
bain d’eau froide.
Verser le contenu du ballon dans une ampoule à décanter contenant
environ 50 mL d’eau salée. Agiter prudemment quelques instants en
dégazant régulièrement, puis éliminer la phase aqueuse.
Etape 3.
Ajouter alors à la phase organique 60 mL d’une solution aqueuse
d’hydrogénocarbonate de sodium (Na(aq) + + HCO 3(aq) -)
de concentration molaire 1 mol.L -1.
Laisser dégazer
et décanter puis éliminer la
phase aqueuse. Recueillir la phase organique dans un bécher. Sécher
cette phase avec du chlorure de calcium anhydre puis filtrer.
Recueillir le filtrat dans un erlenmeyer propre et sec.
Une synthèse réalisée au laboratoire en suivant ce protocole a permis
d’obtenir un volume de filtrat égal à 5,9 mL.
Données :
Couple acide/base : H2O,CO2(aq) / HCO3(aq)-).
|
Acide
acétique
|
Ethanol
|
Acétate
d'éthyle
|
Masse
molaire (g/mol)
|
60,0
|
46,1
|
88,1
|
Masse
volumique ( g/L)
|
1,05
|
0,789
|
0,925
|
Température
d'ébullition °C
|
118
|
78,4
|
77,1
|
Température
de fusion °C
|
16,6
|
-117
|
-83,6
|
Solubilité
dans l'eau
|
Très
grande |
Très
grande
|
87 g/L
à 20°C |
Solubilité
dans l'eau salée
|
Très
grande
|
Tres
grande
|
Presque
nulle
|
Réaction de synthèse.
La synthèse de l’acétate d’éthyle est modélisée par la réaction
d’équation :
CH3COOH(l) + C2H5OH(l) ⇌ CH3COOC2H5(l)
+ H2O(l).
Identifier,
en justifiant votre réponse, les fonctions chimiques des molécules
organiques intervenant dans la réaction de synthèse.
CH3COOH(l) : groupe
carboxyle ( fonction acide carboxylique ).
C2H5OH(l) : groupe hydroxyle
( fonction alcool primaire).
CH3COOC2H5(l)
: ester.
Quel est le nom de
l’acétate d’éthyle en nomenclature officielle ?
Ethanoate d'éthyle.
|
.
.
|
|
|
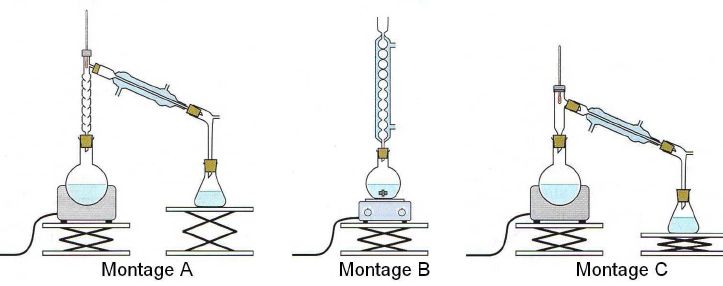
Parmi les montages
suivants, justifier celui qu’il convient de choisir pour l’étape 1.
Pourquoi
les deux autres montages ne conviennent-ils pas ?
Le
montage B est un montage à chauffage à reflux. Les vapeurs se
condensent dans le réfrigérant droit et retombent dans le milieu
réactionnel, il n'y a pas de perte de matière.
Montage C : distillation simple ; montage A : distillation fractionnée.
Par distilmlation, l'espèce la plus volatil l'alcool est enlevé du
mélange réactionnel.
Proposer
un titre pour nommer chacune des trois étapes du protocole.
Etape (1) : synthèse utilisant un dispositif de chauffage à reflux.
Etape 2 : extraction de la phase organique par décantation.
Etape 3 : purification de la phase organique et récupération de l'ester.
Justifier,
en argumentant avec une équation de réaction si cela est nécessaire, le
choix dans ce protocole des conditions opératoires suivantes :
- ajout d’acide sulfurique concentré : cet acide joue le rôle de
catalyseur, il accélère la réaction.
- chauffage à reflux : la température est un facteur cinétique.
- mélange avec de l’eau salée : l'ester est insoluble dans l'eau salée.
- ajout d’une solution aqueuse d’hydrogénocarbonate de sodium :
élimination de l'acide sulfurique et de l'acide acétique.
HCO3(aq)- +H3O+aq
= 2H2O + CO2(g).
|
.
|
|
Rendement.
Déterminer la valeur du rendement de la synthèse en expliquant la méthode mise en oeuvre.
Les réactifs sont en proportions stoechiométriques ; dans le cas d'une réaction totale on obtiendrait 0,10 mol d'ester.
Masse d'ester obtenu : 5,9 * 0,925 =5,46 g.
Quantité de matière d'ester : 5,46 / 88,1 =0,062 mol.
Rendement = 0,062 / 0,10 = 62 %.
Est-il exact de dire que ce rendement est égal à la proportion d’éthanol consommé au cours de la transformation ? Commenter.
Non, il faut tenir compte des pertes lors des étapes 2 et 3.
Mécanisme réactionnel.
Le mécanisme réactionnel modélisant la réaction de synthèse de
l’acétate d’éthyle à partir de l’acide acétique et l’éthanol comporte
cinq étapes représentéesci-dessous :
Quels groupes d’atomes correspondent respectivement aux lettres R et R’ ?
R correspond à CH3 et R' à CH3-CH2.
Compléter les étapes 1 à 5 avec une ou plusieurs flèches courbes, si nécessaire. Que représentent ces flèches courbes ?
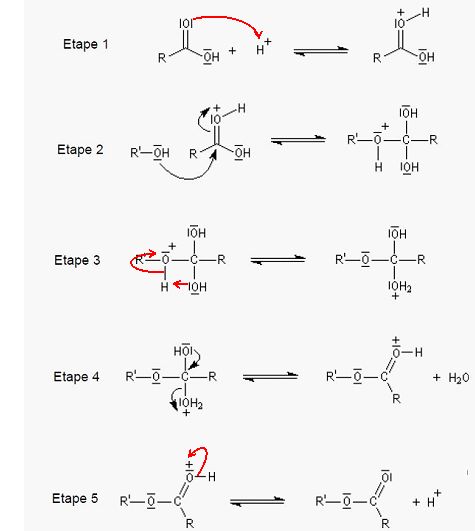
Les flèches courbes représentent un transfert de doublet électronique d'un site donneur vers un site accepteur.
Donner la catégorie des réactions des étapes 2 et 4, dans le sens direct.
Etape 2 : addition nucléophile sur le carbonyle
Etape 4 : élimination d'une molécule d'eau.
D’après le mécanisme proposé, quel est le rôle joué par H+ dans la synthèse de l’acétate d’éthyle ? Commenter.
H+ est un catalyseur. Il réagit à la première étape du
mécanisme et est régénéré à la dernière étape. Il modifie le mécanisme
réactionnel.
|
|
|