Photocatalyse et nanoparticules de
dioxyde de titane.
Bac S
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Depuis
2001, on trouve dans le commerce des vitres dites « auto-nettoyantes ».
Ces vitres sont recouvertesd’une couche transparente de nanoparticules
de dioxyde de titane TiO2. Sous l’action de la lumière
solaire, cette couche facilite la réaction de décomposition, par le
dioxygène et l’eau, des matières organiques présentes dans les
salissures. Les produits de cette dégradation sont solubles dans l’eau
et facilement éliminés par la pluie. Ce phénomène de catalyse d’une
réaction chimique par l’action de la lumière s’appelle photocatalyse.
Montrer que la lumière solaire permet l’action photocatalytique du dioxyde de titane recouvrant les vitres auto-nettoyantes.
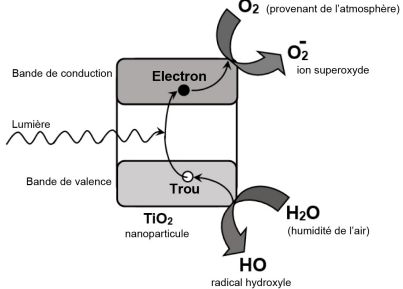
Les niveaux d’énergie électroniques d’une nanoparticule de dioxyde de titane TiO2 sont
quantifiés, très resserrés, et regroupés en « bandes » d’énergie.
Seulement 3,2 eV séparent la bande de valence de la bande de conduction.
Energie d'un photon solaire du proche UV ( l ~350 nm ) : E = h c/l = 6,6 10-34*3,0 108 / (350 10-9) ~5,7 10-19 J
ou 5,7 10-19 / (1,6 10-19) =3,5 eV
L'absorption d'un photon du proche UV par une nanoparticule de TiO2
permet à un électron de passer de la bande de valence à la bande de
conduction. Ce dernier, capturé par une molécule de dioxygène adsorbée
à la surface du catalyseur, conduit à la formation d'un ion superoxyde O2-.
Simultanément, l'eau présente dans l'atmophère cède un électron à la
bande de valence : il en résulte un radical hydroxyle et un ion H+.
Le radical hydroxyle et l'ion superoxyde, très réactifs, oxydent alors la matière organique des salissures.
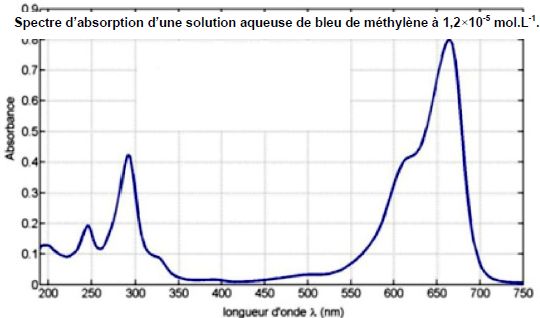
Vérification expérimentale de l’effet catalytique de TiO2 sur la dégradation du bleu de méthylène.
Justifier la longueur d’onde choisie dans le suivi spectrophotomètrique.
Pour une plus grande précision, on choisit une longueur d'onde pour
laquelle le bleu de méthylène présente un maximum d'absorption. l = 660 nm.
|
| .
. |
|
|
Le suivi spectrophotomètrique réalisé permet-il de vérifier que le dioxyde de titane est un catalyseur ?
A la longueur d'onde choisie, seul le bleu de méthylène absorbe ; de
plus les produits de la décomposition de ce dernier par le dioxygène
sont tous incolores.
L'absorbance dans le becher A ( solution de bleu de méthylène, sans
catalyseur, agitation, exposition à la lumière UV ) reste pratiquement
constante durant quelques heures. Le bleu de méthylène n'est pas
décomposé par le dioxygène de l'air.
Le becher B est placé dans les mêmes conditions expérimentales ; il contient en plus 300 mg de dioxyde de titane.
L'absorbance, initialement identique à celle du becher A, diminue au
cours des heures ; elle est voisine de zéro au bout de quelques heures.
Le dioxyde de titane catalyse donc la décomposition du bleu de méthylène par le dioxygène de l'air.
Comment compléter le protocole afin de montrer que le dioxyde de titane Degussa® P25 est un photocatalyseur ? Décrire les résultats attendus par la mise en oeuvre de ce protocole.
On pourrait reprende le protocole sans exposer les bechers à la lumière UV.
Dans ce cas, le dioxyde de titane ne peut plus jouer le rôle de
catalyseur et l'absorbnace dans les deux bechers restera constante. TiO2 est donc bien un photocatalyseur.
On pourrait également modifier la taille des molécules de TiO2 et montrer qu'au delà de 100 nm de diamètre ce dernier ne joue plus son rôle de photocatalyseur.
|
.
|

