Synthèse verte du phénol. Bac S
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Quelle valeur maximale l'économie d'atomes EA peut-elle atteindre ? Justifier simplement.
L’Économie d'Atomes (EA) d’une synthèse est définie comme le rapport de la somme des masses molaires
du (ou des) produit(s) recherché(s) sur la somme des masses molaires de tous les réactifs en tenant compte
des coefficients stoechiométriques.
Lorsqu'il n'y a pas de sous produits, l'économie d'atome atteint sa valeur maximale, c'est à dire EA=1.
Écrire l’équation de la réaction qui modélise la synthèse du phénol pour chacun de ces deux procédés.
Procédé au cumène :
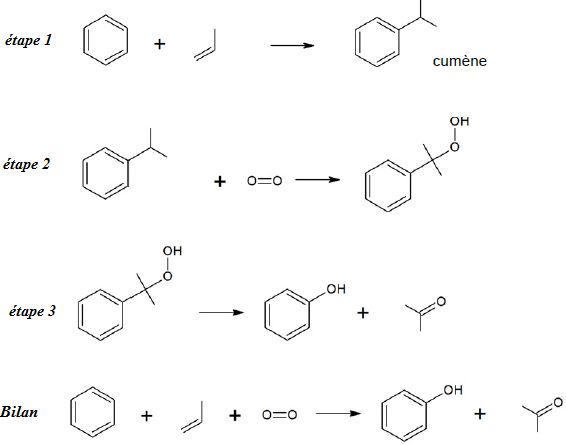
|
| .
. |
|
|
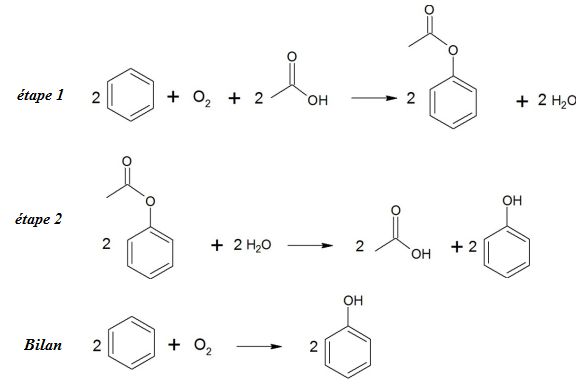
Second procédé :
Calculer la valeur de l’économie d’atomes dans le cas de la mise en oeuvre du procédé n°1. On considère
que la seule espèce chimique désirée est le phénol.
M(phénol) = 6*12+6+16 = 94 g/mol ; M(benzène) = 78 g/mol) ; M( dioxygène) = 32 g/mol ;
M(propène) = 3*12+6= 42 g/mol.
EA = 94 /(78+42+32) =0,62.
|
.
|
|
D’après les données fournies, indiquer en le justifiant précisément le procédé qui vous parait le plus performant dans le cadre du respect des principes de la chimie verte. De quelles autres informations faudrait-il disposer afin de compléter la réponse ?
Le procédé 1 posséde une EA bien inférieure à l'unité ; le propène, issu du pétrole (énergie non renouvelable ) est utilisé.
Ce processus est assez gourmand en énergie ( température voisine de 200°C et pression de 34 bar dans la première étape ).
Par contre ce processus peut valoriser un sous produit, l'acétone utilisée comme solvant.
Pour le procédé 2, l'économie d'atome atteint la valeur maximale, il
n'y a pas de déchets. De plus l'un des réactifs est le dioxygène issu
de l'air.
L'acide éthanoïque, l'un des réactifs de la première étape, est
régénéré lors de la seconde étape ; de plus il peut être obtenu
par oxydation ménagée de l'éthanol, lui même fabriqué à faible
coût à partir de la canne à sucre.
Par contre l'une des étapes est gourmande en énergie, l'hydrolyse s'effectuant à 600 °C.
Ce second procédé présente donc plus davantage que le premier du point de vue de la chimie verte.
Il nous faudrait de plus connaître le coût des réactifs et des
catalyseurs ( palladium en particulier ), les rendements de chaque
étape, la nocivité des intermédiaires réactionnels.
|
|
|

