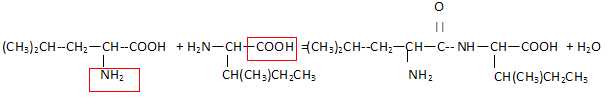A
la recherche des molécules de la vie. Bac S Asie 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
En
1953, S. Miller a enfermé dans un ballon des gaz ( méthane, ammoniac,
dihydrogène et eau ) et soumis le mélange à des décharges électriques
pendant sept jours. Il a obtenu des molécules organiques, les briques
du vivant, et notamment de l'urée CON 2H 4, du formaldehyde H 2CO, de l'acide cyanhydrique HCN et des acides aminés.
Quel scénario des origines de la vie voulait mettre en évidence Miller ?
Les
premières molécules organiques auraient pu se former sur la terre par
réactions chimiques entre certains constituants de l'atmosphère
primitive, l'énergie étant apportée par les éclairs lors des orages..
Justifier le choix des réactifs fait dans son expérience.
Les
acides aminés renferment les éléments azote, carbone, hydrogène et
oxygène. Il fallait ensuite reconstituer l'atmosphère primitive
renfermant des molécules gazeuses simples contenant les éléments cités
précédemment.
La formule générale des acides aminés est donnée ( R est un radical
variable d'un acide aminé à un autre ; il peut être H, un groupe
alkyle, une chaîne comportant des groupes caractéristiques divers ).
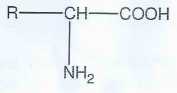
Justifier son appartenance
à la famille des acides aminés. Un acide a-aminé comporte un groupe amine
NH 2 et un groupe carboxyle COOH portés par le même carbone :
l'alanine est un acide a-aminé. On donne les formules de l'urée et du formaldehyde. Représenter, en le justifiant, l'ensemble des doublets libres présents dans la molécule d'urée.  L'atome
d'oxygène compte six électrons externes ; deux sont engagés dans deux
liaisons avec le carbone, il reste donc quatre électrons non liants (
deux doublets). L'atome
d'azote compte cinq électrons externes ; trois sont engagés dans trois
liaisons avec le carbone et les hydrogènes, il reste donc deux
électrons non liants ( un doublet).
Quel est le nom officiel du formaldehyde ?
Le méthanal.
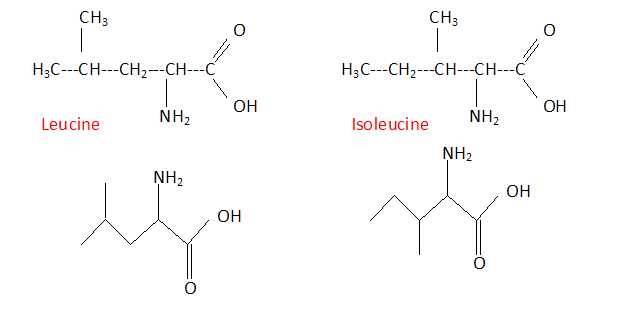
On donne les formules semi-développées de la leucine et de l'isoleucine.
Ecrire la formule topologique de la leucine. Quelle relation lie ces deux molécules ?
Ces deux molécules sont deux isomères de chaîne. Elles se différencient uniquement par leur chaîne carbonée.
|
| .
. |
|
|
Quelle(s) technique (s) peut(vent) être choisie(s) pour les diférencier.
La spectroscopie IR n'est pas adaptée, les deux molécules possédant les mêmes fonctions chimiques.
La
spectroscopie de masse n'est pas le meilleur moyen pour les
différencier : les chaînes carbonées n'étant pas identiques, on
observera des fragments différents mais on observera le même pic
moléculaire..
La
spectroscopie RMN du proton est la mieux adaptée : le nombre de groupe
d'atomes d'hydrogène équivalents est différents pour la leucine et
l'isoleucine.
On réalise les spectres RMN des deux molécules en ajoutant un peu d'eau lourde D2O. Cela permet de faire disparaître les signaux dus aux protons des groupes COOH et NH2.
L'un de ces deux spectres est donné ci-dessous et comporte :
- un doublet à d = 0,9 ppm intégrant pour 6 H ;
- un multiplet non résolu à d = 1,5 ppm intégrant pour 1 H ;
- un triplet à d = 1,6 ppm intégrant pour 2 H ;
- un triplet à d = 3,4 ppm intégrant pour 1 H.
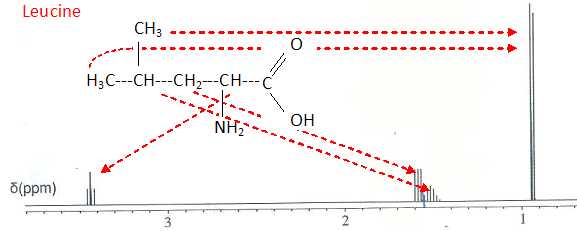 Ce spectre est-il celui de la leucine ou de l'isoleucine ? Justifier par deux arguments.
La
leucine possède deux groupes méthyles équivalents soit 6 protons
équivalents. Ces six protons sont couplés avec un seul hydrogène.
(- un doublet à d = 0,9 ppm intégrant pour 6 H ; - un multiplet non résolu à d = 1,5 ppm intégrant pour 1 H ).
L'isoleucine possède l'ensemble H3C-CH2 - ( triplet à 1 ppm intégrant pour trois protons et un multiplet vers 1,5 ppm intégrant pour deux protons). L'isoleucine possède l'ensemble H3C-CH - ( doublet à 1 ppm intégrant pour trois protons).
|
.
|
|
On envisage que la synthèse des acides aminés puisse s'opérer dans l'espace.
Quel(s) paramètre(s) semble(nt) pouvoir avoir un effet favorable ou défavorable à la réalisation de synthèse dans l'espace.
Paramètres favorables
: l'espace renferme les molécules simples de base à l'élaboration
d'acides aminés ainsi que des catalyseurs ( carbone et silicates ).
Une
lumière polarisée agit de manière différente avec un énatiomère
"gauche" et un énantiomère "droit". En absorbant une lumière polarisée,
les molécules optiquement actives se dégradent en donnant un excès
d'énantiomére gauche ou droit.
Paramètre défavorable : la température de l'espace est très basse et la température est un facteur cinétique.
La preuve expérimentale.
Les
chercheurs on reproduit en laboratoire un échantillon de glace de
comète ; cette glace a été soumise à une lumière UV polarisé rencontrée
dans les milieux interstellaires. Une analyse du résidu organique
montre un excès d'énantiomère gauche, comparable à celui mesuré dans
les comètes primitives.
L'homochiralité du vivant a donc bien une origine extra-terrestre.
Les
molécules produites et utilisées par tous les êtres vivants de la terre
sont chirales, alors que les réactions de synthèses chimiques
produisent en général des mélanges dits "racémiques".
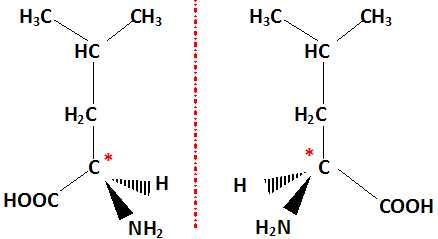
Que signifient les termes racémique et chirale ?
Une molécule chirale n'est pas superposable à son image donnée par un miroir plan.
Un mélange racémique contient les deux énantiomères en proportions égales.
Illustrer ces deux termes à l'aide de la leucine.
La leucine possèdant un atome de carbone asymétrique est chirale : il existe deux énantiomères.
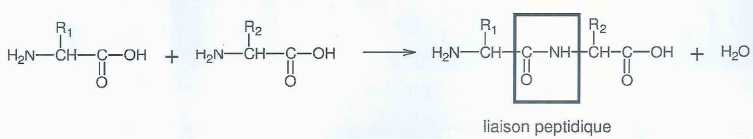
Les
chimistes se sont efforcés de reconstituer en laboratoire les familles
de longues chaînes biologiques indispensables au fonctionnement de la
cellule. Il faut pour cela réaliser des enchaînements d'acides aminés à
l'aide d'une réaction nommée synthèse peptidique dont l'équation
générale est donnée ci-dessous :
A partir d'un mélange initial de leucine et d'isoleucine, combien de dipeptides différents peut-on à priori obtenir ? Justifier.
On peut obtenir 4 dipeptides différents, chaque molécule d'acides
aminés possédant un groupe amine un groupe acide carboxylique.
Deux
molécules de leucine peuvent réagir ensemble et conduire au dipeptide
Leu-Leu. De même pour l'isoleucine, le dipeptide étant isoleu-isoleu ou Ile-Ile.
La leucine peut réagir avec l'isoleucine et conduire à deux dipeptides : Leu-isoleu , isoleu-Leu.
Les dipetides obtenus possédant des groupes NH2 et COOH peuvent continuer à réagir en formant des tripeptides, puis de polypeptides.
Ecrire
l'équation de la synthèse du dipeptide Leu-Ile en indiquant en rouge
les groupes qui doivent être protégé pour obtenr ce seul dipeptide.
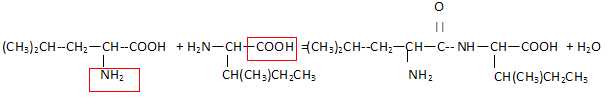
La synthèse d'un dipeptide donné demande ainsi plusieurs étapes schématisées ci-dessous :

Expliquer
en quelques lignes pourquoi réaliser chimiquement la synthèse d'une
protéine donnée ( plus de 50 acides aminés) reste un défi industriel.
A chaque formation d'une liaison peptidique, les réactions de
protection-déprotection introduisent deux nouvelles étapes dans la
synthèse. Ces dernières doivent être réalisables avec d'excellents
rendements ( 99,9 %). Lorsque les acides aminés possèdent des fonctions
sur des chaînes latérales, il faut de plus protéger ces groupes
fonctionnels.
|
|
|