Iode 131,
cobalt 60, dosage de la vitamine C, concours Manipulateur
électroradiologie
médicale Clermont 2013.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Radioéléments
utilisés en médecine.
L'iode 131 est utilisé en scintigraphie thyroïdienne.
| Noyau |
Sb |
Te |
I |
Xe |
Cs |
| Z |
51 |
52 |
53 |
54 |
55 |
Donner le
composition de son noyau.
53 protons et 131-53 = 78 neutrons.
Cet isotope est radioactif ß-.
Ecrire
l'équation de sa désintégration en précisant les lois utilisées et le
nom de la particule émise.
13153I
---> AZX +0-1e.
Conservation de la charge : 53 = Z -1 d'où Z = 54.
Conservation du nombre de nucléons : 131 = A +0.
13153I
---> 13154Xe +0-1e.
La particule émise est un électron.
La
demi-vie de l'iode 131 est d'environ 8 jours.
Donner
la définition de la demi-vie radioactive.
La demi-vie, noté T, est la durée au bout de laquelle l'activité
initiale est divisée par 2.
Si l'activité initiale est A0, quelle
sera son activité au bout de 32 jours ?
32 jours est égal à 4 demi-vie. L'activité initiale est
divisée par 24 =16 et l'activité au
bout de 32 jours vaut :
A0/16 =0,0625 A0.
Quelle
est l'unité de l'activité ?
L'activité s'exprime en becquerel ( Bq).
La désintégration de l'iode s'accompagne d'une émission g d'énergie 300
keV environ.
Quelle
est la nature de cette émission ?
Les rayons gamma sont des ondes électromagnétiques.
Calculer
une valeur approchée de sa fréquence.
h = 6,63 10-34 J s ; 1 eV = 1,6 10-19
J.
E = h n ;
n
= E / h = 300 103*1,6 10-19 / (6,63 10-34)=7,2 1019
Hz.
|
|
|
Le cobalt 60 est
utilisé en radiothérapie. Il est ontenu artificiellement à partir du
cobalt naturel 9 qui capture une particule.
Ecrire
l'équation de cette transformation et identifier la particule capturée. Z(Co) = 27).
5927Co
+ 10n --->6027Co.
La particule capturée est un neutron.
Le cobalt 60 se transforme spontanément en nickel par émission ß-.
Ecrire
l'équation de cette désintégration.
6027Co
---> 6028Ni
+0-1e.
Cette transformation s'accompagne d'une libération d'énergie.
Donner
l'expression de cette énergie en précisant la signification et l'unité
de chaque granndeur.
Défaut de masse Dm = m(0-1e) + m(6028Ni) - m(6027Co)
Energie libérée : E = Dm c2.
m(0-1e) : masse de
l'électron en kg ; m(6028Ni) : masse du
noyau de nickel 60 en kg ; m(6027Co) : masse du
noyau de cobalt 60 en kg. c : célérité de la lumière dans le vide ( m /
s). E : énergie libérée en joule.
|
.
|
|
Dosage de la vitamine C.
La molécule de vitamine C ou acide L-ascorbique est représentée.
Entourer et nommer les groupes caractéristiques qu'elle contient. Localiser les atomes de carbone asymétriques.
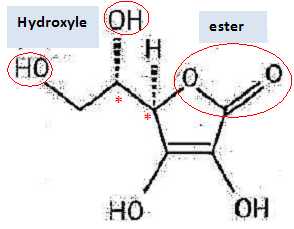
Combien de diastéréoisomères de configuration possède-t-elle ?
La présence de deux atomes de carbone asymétriques permet de prévoir 4 isomères. ( deux couples d'énantiomères ).
On souhaite vérifier la masse d'acide ascorbique C6H8O6 dans un comprimé de vitamine "C500".
Pour cela, on réalise V = 100,0 mL de solution S avec un comprimé dissout dans l'eau distillée. On en prélève Vs = 10,0 mL que l'on titre avec une solution d'hydroxyde de sodium ( Na+aq + HO-aq) de concentration c = 2,0 10-2 mol/L.
Ecrire l'équation de la réaction de titrage.
C6H8O6 aq+ HO-aq ---> C6H7O6-aq + H2O.
Déterminer le volume de solution titrante versé à l'équivalence en précisant la méthode utilisée.
La méthode des tangentes.
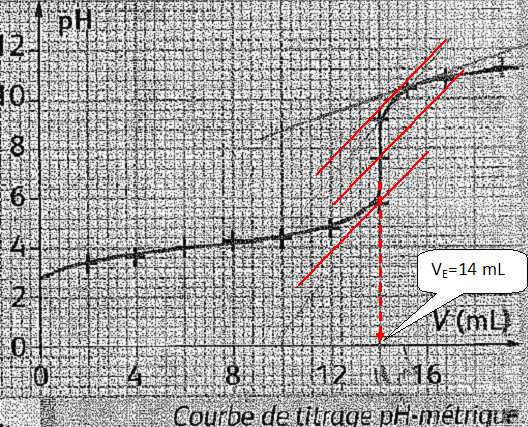
|
Définir l'équivalence.
A
l'équivalence les quantités de matière des réactifs sont en proportions
stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès,
après l'équivalence, l'autre réactif est en excès.
En déduire la relation à l'équivalence puis la quantité d'acide ascorbique dans l'échantillon dosé.
Quantité de matière d'ion hydroxyde : c VE.
Quantité de matière d'acide ascorbique : [C6H8O6] Vs.
c VE=[C6H8O6] Vs = 2,0 10-2 *0,014 =2,8 10-4 mol dans 10 mL.
En déduire la quantité puis la masse d'acide ascorbique contenue dans le comprimé. Conclure. M(C6H8O6) = 176 g/mol.
2,8 10-3 mol d'acide ascorbique dans 100 mL.
Masse d'acide ascorbique dans un comprimé : 2,8 10-3 *176 = 0,493 m ou 493 mg.
Ecart relatif : (500-493) / 500 = 1,4 10-2 ou 1,4 %.
Le résultat du dosage confirme l'indication "C500".
L'acide ascorbique est aussi un réducteur.
Ecrire l'équation de la réaction de l'acide ascorbique avec le diiode.
Couple oxydant / réducteur : I2/I- ; C6H6O6 /C6H8O6 .
Réduction du diiode : I2+2e- = 2I- ;
oxydation de l'acide ascorbique : C6H8O6 = C6H6O6 +2H+ +2e-.
I2+C6H8O6 = 2I- +C6H6O6 +2H+.
|
|