|
|
|
|
Spectre
d'émission de l'atome de mercure.
Ce spectre présente une raie ultraviolette de longueur d'onde l
= 254 nm. Les raies du spectre de l'atome de mercure résultent des
transitions entre ses différents niveaux d'énergie. Le diagramme
ci-dessous représente, sans souci d'échelle, certains niveaux d'énergie
de l'atome de mercure.
E0 désigne l'état fondamental de l'atome de
mercure, c'est à dire son niveau de plus basse énergie.
Données
: h = 6,63 10-34 J s ; c = 3,00 108
m/s ; 1 eV = 1,60 10-19 J.
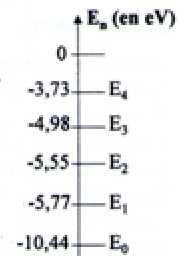
Déterminer
la transition énergétique responsable de la raie violette.
E1 --> E0 ; E2 --> E0
; E3 --> E0
; E2 --> E1
; E4 --> E1
; aucune réponse exacte.
DE
= hc/l =
6,63 10-34*3,00 108 /
(254 10-9) =7,83 10-19 J.
7,83 10-19 /
(1,60 10-19) =4,89 eV.
Cette différence d'énergie correspond à E2 --> E0.
Niveaux
d'énergie.
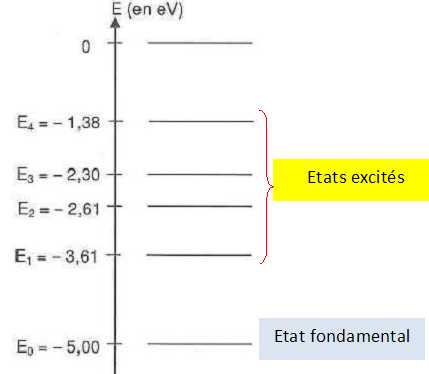
L'énergie des
niveaux quantifiés de l'atome d'hydrogène est donné par la relation : En = -13,6 / n2 exprimée en eV
avec n entier non nul.
E1 = -13,6 eV ; E2 = -3,4 eV ; E3 = -1,5 eV; E4 = -0,85 eV.
h
= 6,63 10-34 Js ; c = 3,00 108 m/s ; e = 1,6 10-19 C ; hc/e = 1,24
10-6 SI.
A)
"h" est appelée constante de Planck. Vrai.
B)
E1 est le niveau
fondamental et E2, E3 et E4 sont des niveaux
excités de l'atome. Vrai.
C)
Lorsque l'atome d'hydrogène passe du niveau d'énergie n = 3 au
niveau d'énergie n= 2, il y a émission d'un photon de longueur d'onde l
= 653 nm. Vrai.
DE
= h c / l
; l
= hc / DE
= hc / (e (3,4-1,5)) = 1,24 10-6
/ 1,9 =0,653 10-6
m = 653 nm.
D)
La radiation précédente appartient au domaine infrarouge. Faux.
653
nm appartient à [400 nm ; 800 nm], c'est à dire au domaine visible.
E)
L'atome d'hydrogène pris dans son état fondamental peut absorber un
photon d'énergie 10,6 eV. Faux.
-13,6
+10,6 =-3,0 eV, ce qui ne correspond pas à un niveau d'énergie de
l'atome.
|
.
|
Transferts
quantiques d'énergie.
A) Par absorption d'un quantum d'énergie, une molécule peut passer d'un
niveau inférieur à un niveau supérieur. Vrai.
Diffraction
par une fente
de largeur proche de la longueur d'onde de la lumière.
B) Une transition d'énergie dite vibratoire est associée à une
radiation infrarouge. Vrai.
q
= l /a ~
½l
/ D ; l =
al
/(2D).
C) Un laser émet une lumière polychromatique directive. Faux.
La lumière laser est
quasi-monochromatique.
D) Les états excités sont caractérisés
par une
énergie inférieure à celle de l'état fondamental. Faux.
Spectre
d'émission d'une étoile. réponse B, C,
L'analyse de ce spectre permet de connaître :
A) la température de surface.
B) la composition
chimique de "l'atmosphère" de l'étoile : les astronomes
ont remarqué dès le XVIIIe siècle la présence de fines bandes noires
dans la lumière solaire. Il manque des couleurs très précises et
spécifiques, comme si elles ne nous étaient pas parvenues. Après
quelques tâtonnements, ils ont compris que ces raies sombres
trahissaient la présence d'éléments chimiques sur le trajet des rayons
lumineux. Joseph von Fraunhofer fut le premier en 1814 à observer ces
disparitions de lumière et à les attribuer à un phénomène d'absorption
par un gaz situé entre la source d'émission et l'observateur.
C) sa
vitesse de déplacement : l’observateur
mesure la longueur d’onde l0
du signal lumineux émis par une source immobile.
L’observateur
mesure la longueur d’onde l’ du signal
lumineux émis par la même source s’éloignant à la vitesse v.
On
obtient l'
> l0.
D) la valeur du
champ de gravitation à la surface.
E) la masse.
|
|
Principe du
laser.
Le principe du laser réside dans l'émission stimulée des atomes
présents dans un gaz, un liquide ou un cristal. Un apport d'énergie
fait passer une grande proportion d'atomes dans un état excité Ex.
Ces atomes se désexcitent rapidement vers le premier état excité E2
appelé état métastable. Cette étape est appelée inversion de population
et elle est réalisée par pompage optique. Considérons un atome
quelconque se trouvant dans l'état d'énergie E2. Si une
radiation de fréquence n,
telle
que hn = E2- El,
rencontre cet atome, elle va provoquer sa désexcitation par émission
stimulée.
Données :
La constante de Planck est h = 6,6x 10-34J.s ; 1 eV= 1,60 x
l0-19J ; la célérité de la lumière est c = 3,00 x 108 m.s-1
;
El =-10,7 eV ; E2=-8,7eV ; 66 x 3 /1,6 ~ 124 ;
1,6 / (66*3) ~8 10-3.
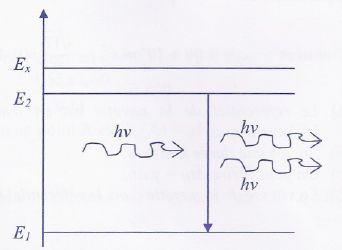
Diagramme d'énergie - Emission stimulée
a) Lors de l'émission stimulée, un photon identique au photon incident
est émis par l'atome. Vrai.
b) L'énergie d'un photon émis est Ephoton= 3,20 x l0-19
J. Vrai.
E2- El =
-8,7 + 10,7 = 2,0 eV = 2,0 *1,6 10-19 =3,2 10-19
J.
c) Le laser utilisé émet un rayonnement
monochromatique de longueur d'onde l
=1240 nm. Faux.
l = hc / (E2-E1)
=6,6 10-34 * 3,00 108
/ (3,2 10-19) =6,6 *3 / 3,2 10-7
=12,4 / 2 10-7 =6,2 10-7
m = 620 nm.
d) L'énergie d'un laser est concentrée dans un pinceau très étroit.
Vrai.
|
|